تقنية النانو
تقنية النانو، نانوتكنولوجي Nanotechnology
في الصيدلة
في الوقت الحاضر يهتم الباحثين بتحقيق ثلاث أهداف رئيسية:
- التحكم بشكل أفضل بآلية تحرر المواد الفعالة liberation kinetic of
- حل مشاكل مراقبة المعالجة لدى المرضى problems Observance
- رفع نوعية أو اصطفائية الأدوية Medicament specificity
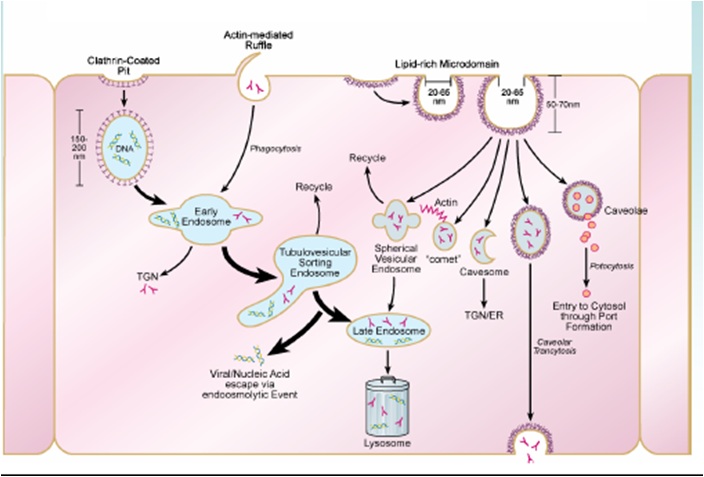
النواقل الضمخلوية للأدويةIntracellular drug carrier
أشكال ذات تراكيب مختلفة، ولكنها دائماً صغيرة الحجم فلا يتجاوز حجمها الميكرون ويمكنها أن تحوي مادة دوائية أو أكثر وقادرة على إيصال محتواها من هذه المواد لداخل الخلايا الحية بشكل اصطفائي.
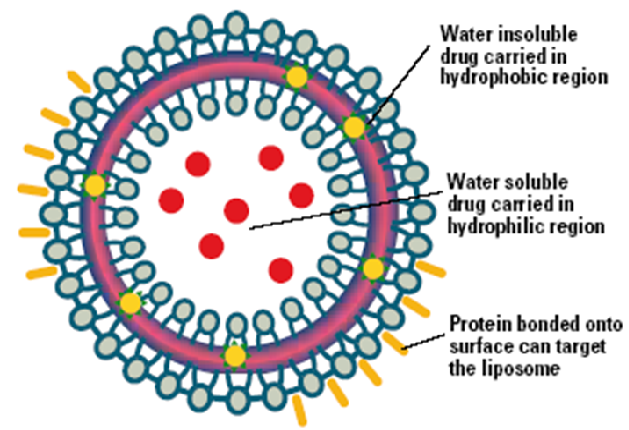
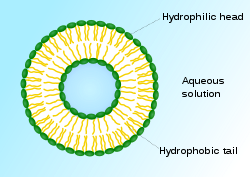
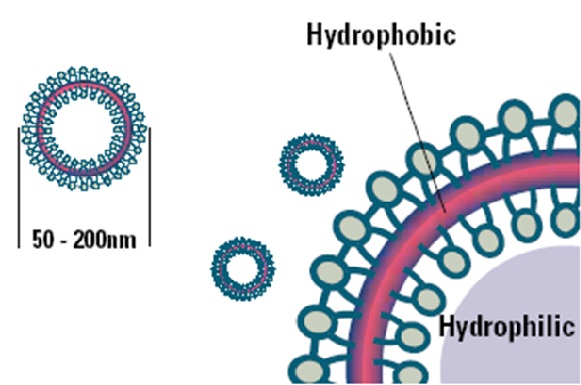
الليبوزوم
حويصلات صغيرة كروية الشكل تتراوح أقطارها بين عشرات النانومترات إلى عشرات الميكرومترات وتتميز بثلاث نقاط رئيسية:
- تحوي في الداخل على الماء أو محلول مائي.
- يمكن أن يحوي الليبوزوم وبالتالي ينقل، مواد منحلة بالماء Hydrosolubles ومواد منحلة بالدسم Liposoluble.
- تتوضع المواد المنحلة بالماء داخل التجويف المائي و تتوضع المواد المنحلة بالدسم في جدار الليبوزوم الليبيدي.
استخدم الليبوزوم كنموذج لدراسة نفوذية الغشاء الخلوي.
يتشكل الغلاف من طبقتين من الجزيئات الفوسفولبيدية.
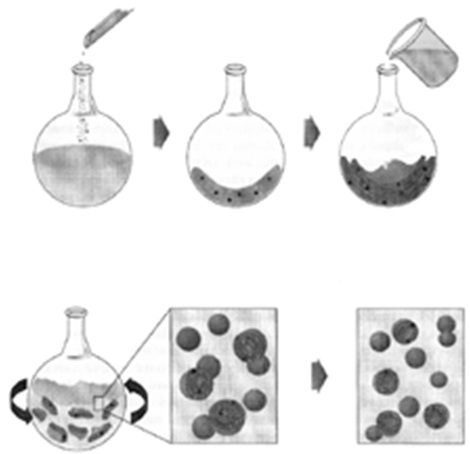
طريقة التحضير
تشمل طريقة التحضير المراحل التالية:
- حل الفوسفولبيد و المواد الأخرى المكونة للجدار في محلول عضوي طيار مثل ال[[كلوروفورمٍٍ.
- تبخير المحل العضوي في مبخر دوار وتحت ضغط منخفض.
- إضافة المحلول المائي الموقى عادة مع التحريك.
- يحصل عادة في هذه الشروط على ليبوزوم متعددة الطبقات MLV .
- تضاف المادة الفعالة في لحظات مختلفة حسبما تكون هذه المادة منحلة في الدسم أو منحلة في الماء.
- فعندما تكون المادة الفعالة منحلة في الدسم تضاف منذ البداية إلى الكلوروفورم.
- وعندما تكون منحلة في الماء تضاف إلى الماء أو الطور المائي.
نسبة الكبسلة Encapsulation percentage
تتعلق نسبة المادة الفعالة المكبسلة بعديد من العوامل منها:
- طبيعة المادة الفعالة وخاصة حجمها الجزيئي.
- تركيبها الكيميائي و انحلاليتها.
- وبشكل عام تكون نسبة المادة المكبسلة كبيرة بالنسبة للمواد المحبة للدسم.
- وفي جميع الأحوال فإن نسبة المادة الدوائية المكبسلة ضئيلة جداً و لا تتجاوز 10 % من كامل الكمية المستعملة في الطرق التقليدية للتحضير.
ثبات الليبوزوم في الزجاجstability In vitro
إن إحدى المشاكل الهامة التي تواجه العاملين في مجال الليبوزوم هي مشكلة خروج الدواء عبر الطبقات المكونة لليبوزوم إلى الوسط الخارجي.
التفاعل مع الخلايا الحية في الزجاج: Interaction with live cells in vitro
من الممكن حدوث أربع أنواع من التفاعلات:
- اجتذاب Adsorption بسيط لليبوزوم على سطوح الخلايا الحية.
- تبادل جزيئي بين جدار الليبوزوم و أغشية الخلايا الحية.
- ظاهرة اندماج fusion بين جدار الليبوزوم و الغشاء الخلوي.
- بلعمة خلوية Endocytoses.
اجتياز بطانة الشعيرات الدموية
تحدد إمكانية الليبوزوم بأن تنتقل بواسطة الدم لتصل إلى الأنسجة المصابة.
يبدو بأن اجتياز الليبوزوم لبطانة الأوعية الدموية في الأنسجة الكبدية سهلاً نوعاً ما بسبب رخاوة هذه الأنسجة، ولكن الأمر سيكون أكثر صعوبة في الأنسجة الأخرى.
إن احتمالات العبور الممكنة و الظواهر المذكورة هي نفسها المذكورة في فقرة تفاعل الليبوزوم مع الخلية الحية.
إن عبور الليبوزوم بطانيات الأوعية الدموية صعب التصور بسبب كبر قطرها.
الثبات في العضوية In vivo stability
بعد الإعطاء عن طريق الوريد: تفاعل مع مكونات المصل:
- أظهرت الدراسات بأن التفاعل يحصل بشكل خاص مع ليبوبروتيئين عالي الكثافة High density lipoproteins HDL.
- بأن التفاعل يترجم بالنسبة لليبوزوم بخسارة في الفوسفوليبيد الذي ينتقل إلى الليبوبروتيئين العالي الكثافة HDL.
- بأن التفاعل يؤدي إلى زيادة نفوذية الليبوزوم و بالتالي خروج المادة الفعالة.
بأن التفاعل يكون على أشده في درجة حرارة تحول أطوار الجملة المستعملة وبهذه الدرجة يسهل التفاعل مع البروتينات .
طرق الإعطاء
- عن طريق الصفاق: لقد استخدم طريق صفاق البطن لزرق العديد من الأدوية المكبسلة في الليبوزوم. يجتاز الليبوزوم جدار الصفاق ويظهر بأن التوزع النسيجي قريب من التوزع الذي حصل عليه عن طريق الزرق الوريدي.
- أما الطرق عبر العضل و تحت الجلد: فقد كانت أقل استعمالاً ويبدو بأن المادة الفعالة تتحرر ببطء في مكان الزرق.
- بعد الحقن عن طريق الدماغ Intracerebrale: تترك الليبوزوم الجملة العصبية المركزية بسرعة.
مدة البقاء في البلاسما
المشكلة هامة نظراً لأن سرعة التصفية تحدد الزمن الذي يكون فيه محتوى الليبوزوم في متناول الأنسجة المحيطة.
لقد درس العديد من الباحثين العوامل المؤثرة على سرعة تصفية المواد الدوائية الموجودة في الليبوزوم من البلاسما.
ولقد كانت جميع النتائج متوافقة:
- يقل انطراح المواد بعد الكبسلة .
- يقل انطراح المواد كلما صغر حجم الليبوزوم.
- يكون الإنطراح أبطأ عندما تكون الليبوزوم غير مشحونة أو ايجابية الشحنة منه عندما تكون سلبية الشحنة.
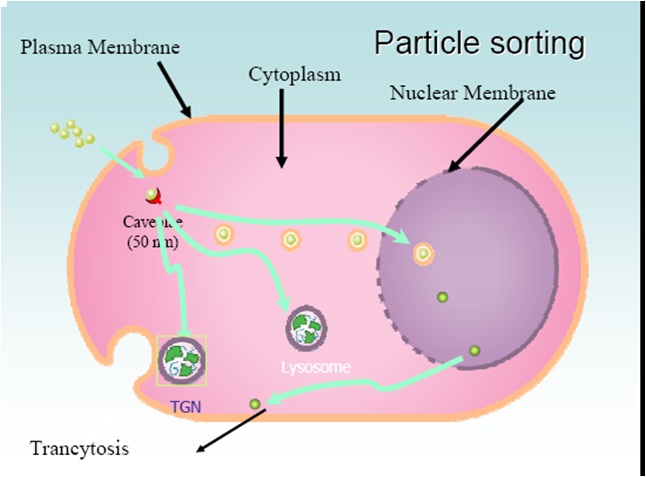
التوزع النسيجي
أهميته كبيرة لأنه يحدد طبيعة الأعضاء التي يصل إليها محتوى الليبوزوم. وقد كانت النتائج منسجمة أيضاً. لليبوزوم كما كان متوقعاً ميل واضح جداً للكبد والطحال.
- تتركز الليبوزوم في الخلايا البالعة الكبيرةMacrophage للطحال وفي خلايا Kupffer وكذلك في الخلايا البطانية الكبدية.
- تتواجد الليبوزوم على المستوى تحت الخلوي في الليزوزوم.
- يكون التركيز في الكبد مهماً.
- يكون التركيز دائماً في الجملة العصبية المركزية قليلاً جداً. وهذا يعود لقدرة الحاجز الدموي الدماغي على منع مرور المواد المستقطبة وكذلك الجزيئات الكبيرة Macromolecules و الليبوزوم.
بحوث في مجال المعالجة
سنرى نتائج المعالجة السرطانية. لم تكن النتائج المحصول عليها كما كان منتظراً أن تكون:
- تسهل الكبسلة بدون شك نفوذ المواد المضادة للسرطان إلى داخل الخلية في الزجاج.
- تبطئ الكبسلة طرح المواد المضادة للسرطان من الدم مما يؤدي إلى رفع فعالية هذه المركبات
- تغير الكبسلة التوزع النسيجي لهذه المواد مما يؤدي إلى نقص في سميتها.
- يؤدي وضع الأكتينومايسين D في اللييبوزوم إلى التقليل من سميته القلبية.
ومن النتائج غير المشجعة بالنسبة لليبوزوم نذكر تلك التي تتعلق بحب الليبوزوم للخلايا السرطانية، إذ كان من المتوقع بأن يكون هناك نوع من الجذب بين الليبوزوم و الخلايا السرطانية اعتمادا على خواص هذه الخلايا الخاصة و قدرتها على البلعمة المتميزة.
أما استخدام طرق خاصة، وخاصة الطريق الرئوي فقد جرب من قبل العديد من الباحثين لمعالجة النقائل Metastases .
ويبدو أن مستقبل البحوث مع الليبوزوم في مجال المعالجة السرطانية قد يكون باستخدام بعض الطرق الخاصة للمعالجة:
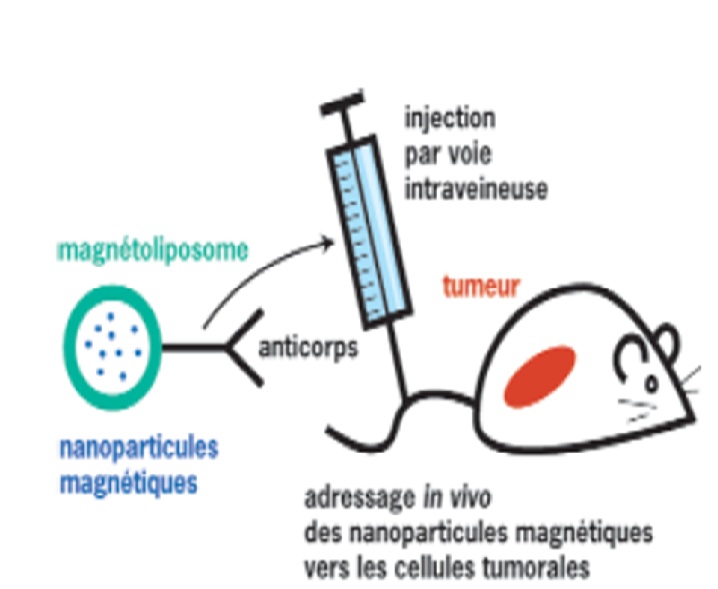
- مثل توجيه الليبوزوم وقيادتها.
- أو باستخدامها لحث وسائط الدفاع في العضوية.
أما توجيه الليبوزوم فقد كان موضوع العديد من الأبحاث الهامة لـ WEINSTEIN وفريقه، وقد جربوا العديد من الطرق بهدف إيصال و تحرير المواد الفعالة في الأنسجة السرطانية.
إحدى هذه الطرق تعتمد على استخدام ليبوزوم درجة حرارة انصهارها أعلى قليلاً من درجة حرارة العضوية. ومن ثم وباستخدام الأمواج القصيرة العمل على رفع درجة حرارة النسيج السرطاني المراد معالجته. وتعتمد الطريقة الثانية على وضع مادة حساسة لدرجة الحموضة في جدار الليبوزوم وعلى درجة حموضة أقل من الطبيعي في السرطانات .
كما حاول العديد من الباحثين لتوجيه الليبوزوم وضع مواد محبة للخلية السرطانية في جدار الليبوزوم. وقد درست الليبوزوم الحاملة للـ Lymphokines و التي لها خاصية حث الخلايا البالعة على قتل الخلايا السرطانيةTumaricides. وأدى إعطائها إلى فئران تحمل الـ Melanomaإلى نقص في ظهور النقائل.
مجالات أخرى
ومن بين النتائج المشجعة نذكر:
- تأثير الليبوزوم الإيجابي على الطرح و على العبور الخلوي للأنزيمات (معالجة الأمراض اللإستقلابية).
- تأثير الليبوزوم الإيجابي على طرح المعادن الثقيلة من العضوية بمساعدة العوامل الطارحة (معالجة التسمم بالمعادن).
- تأثير الليبوزوم على زيادة الفعالية الموضعية للستيروئيدات (معالجة التهاب المفاصل الرثوي).
- تأثير الليبوزوم المذهل على فعالية المشتقات الأنتيموانيةAntimonies ( معالجة اللايشمانيات)Treatment of leishmaniases
- الارتفاع الواضح جداً لإنتاج الأضدادantibodies (استعمال الليبوزوم كمواد مساعدة في التمنيع) Immunization .
- وتعتبر الليبوزوم الحاوية على الهيموغلوبين كريات حمراء صنعية ممتازة.
- كما ولليبوزوم تطبيقات مهمة في مجال الهندسة الوراثية.
النيوزوم Niosomes
طور هذا الصنف من الحويصلات المؤلفة من ليبيدات صنعية غير متشردة ionic lipids Non. R.M.HANDJANI-VILA و فريقه. وقد طور هذا الشكل أيضاً لحل بعض المشاكل في الليبوزوم مثل:
- نسبة التمحفظ المنخفضة في الليبوزوم.
- التخلص من الإصطفائية الزائدة للجملة الشبكية البطانية.
- حل مشكلة حفظ الليبوزوم لفترات طويلة.
تحضير النيوزوم
تسمح الطريقة الجديدة بتحضير النيوزوم على نطاق صناعي وبطاقة إنتاجية عالية. وتتضمن ثلاث مراحل:
- صهر المزيج الليبيدي على درجة حرارة مساوية لـ 110 C˚
- تشكيل الطور الصفائحي على درجة حرارة حوالي الـ 80-70 بإضافة كمية معادلة من محلول مائي للمادة المراد محفظتها.
- تشكيل الحويصلات بمساعدة موزع عالي الطاقة في محلول معادل الضغط الحلولي.
ويمكننا هكذا دون استعمال المحلات الحصول على كميات كبيرة حتى عشرات الكيلو غرامات من النيوزومات التي يتراوح حجمها بين مئة إلى عدة آلاف من النانومترات وذلك حسب طاقة الجهاز المستخدم وفترة التحريك. وللحصول على نيوزومات أصغر يجب استعمال الأمواج فوق الصوتية.
نحصل عادة على نيوزومات من النمط المتعدد الطبقات، و للحصول على نيوزومات وحيدة الطبقة من المفضل استخدام إحدى الطرق المستخدمة في تحضير الليبوزوم.
يسمح التجفيد أيضاً بإطالة فترة حفظ النيوزومات، وتكون النيوزومات المجفدة بشكل مسحوق ثابت وغير قابل للتحول والتجمع والانصهار، ونؤمن بذلك عدم رحلان المواد الدوائية المتمحفظة وأكسدة الليبيدات والتلوث الجرثومي.
التطبيقات العلاجية للنيوزوم
نفس تطبقات الليبوزوم.
الحبيبات النانومترية الأكريلية الغير دروكة حيوياً Nanoparticles non biodegradable
ذكر شبيزر في براءة الاختراع رقم 2.208716، المسجلة في سويسرا 1972. طريقة جديدة لتحضير محافظ أو حبيبات نانومترية. بهدف الحصول على محافظ يمكن إعطائها عن طريق الوريد بدون خطر. تعتمد طريقة التحضير على:
- الحصول على محلول مذيلي داخلي للتفاعل.
- إضافة محلول المادة الدوائية.
- إدخال الموحودmonomer المنحل مع التحريك لداخل المذيلات.
كموحود منحل بالماء يمكننا استعمال: الأكريلاميدacrylamide، والـ N.N.methylene bis acrylamide.
وكموحود منحل بالزيت يمكننا استخدام: مزيج حمض الأكريلي acrylice acid ، والاستر الميتيلي لحمض الأكريلي Methylic ester of acrylic acid .
- يكوثر الموحود المحلول في المذيلات إما بالأشعة أو بالطرق الكيميائية و الفيزيائية وذلك بوجود محرضات للتفاعل catalysers .
- تعزل المحافظ أو الحبيبات النانومترية بفوق الترشيح Ultra filtration أو فوق التثفيلUltra centrifugation بعد إزالة المحلات العضوية بالتقطير.
وبهذه الطريقة تأمل شبيزر الحصول على: محافظ أو حبيبات نانومترية للمواد المحبة للماء - محافظ أو حبيبات نانومترية للمواد المحبة للدسم .
درس كروترKreuter 1983 التركيب الداخلي لهذه المنتجات بطريقة:
- القطع بالتبريدspray freezing .
- الدراسة بالمجهر الإلكتروني.
بينت الصور بأن التركيب الداخلي عبارة: عن كتلة إسفنجية من المتماثر المستعمل في التحضير. دون وجود غشاء حافظ مميز و فجوة داخلية.
الحبيبات النانومترية الأكريلية المحضرة بواسطة KREUTER
طور كروتر طريقته لتحضير الحبيبات النانومترية بالتطبيق على حمات الرشح Influenza virus الطريقة العامة للتحضير هي التالية مع وجود إمكانيتين:
- يمزج معلق أو مستحلب أو محلول غرويدي للمادة الدوائية، مع مكثور منحل في الوسط المستعمل. ومع 0 إلى 3 % وزناً من مادة فعالة على السطح.
- كوثرة الموحود.
- تعلق الحبيبات النانومترية في وسط سائل يحوي على المادة الفعالة فتحصل هكذا على حبيبات نانومترية مشربة بالمادة الفعالة.
يتراوح قطر الحبيبات بين 50 ــ300 نانومتر ولها نفس المظهر و التركيب الداخلي لحبيبات شبيزر. تتميز طريقة كروتر عن طريقة شبيزر بأنها أبسط و لا تتطلب إضافة كميات كبيرة من العوامل الإستحلابية. ◄ نقص في السمية ◄ عدم الحاجة لعمليات التنقية.
يتم تحريض التفاعل بواسطة أشعة γ
الحبيبات النانومترية المصنعة من البروتيئينات الطبيعية
حبيبات الألبومين النانومترية المحضرة على درجات عالية من الحرارة. طور هذه الطريقة العديد من الباحثين.
طريقة التحضير:
- مجانسة كمية قليلة من محلول مائي للألبومين + مادة فعالة في كمية أكبر من زيت نباتي.
- صب المستحلب الناتج في كمية مساوية من الزيت المسخن لدرجة 180 .
- تعمل الحرارة على مسخ البروتين.
- بعد التبريد ترسب الحبيبات بالأيثر وتفصل بالتثفيل ثم تغسل و تجفف.
- تعطي هذه الطريقة حبيبات قطرها بين 0,2 ــ 1,2 ميكرون
- تسبب الحرارة تخرب المواد الدوائية.
لذلك حضر باحثين 1979 حبيبات باستعمال مواد مشبكةreticulation agent، مثلbutadien أو الفورمالدهيد وعلى درجات حرارة منخفضة.
حبيبات نانومترية محضرة بترسيب الجزيئات الضخمة
طريقة التحضير:
- يرسب محلول الجزيئات الضخمة المائي بمساعدة كبريتات.
- تضاف مادة مقسية مثل الغلوتارألدهيد.
- تفصل حبيبات الألبومين أو الجيلاتين بالتجفيد.
حبيبات البولي ألكيل سيانو أكريلات الدروكة حيوياً
حضر كوفرور حبيبات نانومترية تتفكك بالعضوية باستعمال متماثر يتماثر تلقائياً بوجود أثار من الماء أو الأسس الضعيفة.
طريقة التحضير:
- يحضر محلول مائي للمادة الدوائية يحوي على مادة فعالة على السطح على pH = 2 - 3 .
- يضاف الموحود ببطء ومع التحريك للمحلول السابق .
- يتكوثر الموحود فوراً وعلى درجة حرارة المخبر.
محافظ البولي ألكيل سيانو أكريلات النانومترية نمط ماء/زيت Nanocapsules de polyalkylcyanoacrylate
طريقة التحضير:
- تحضير مستحلب م/ز
- يحل الموحود Monomère في الطور العضوي.
- تحل المادة العاتمة للأشعة Radio opaqueفي الطور المائي.
- يتم التحضير بواسطة الأمواج فوق الصوتية Ultrason.
- تعطي هذه الطريقة محافظ نانومترية م/ز.
- تكون نسبة التمحفظ 100 % في وسط التحضير.
- بعد التخلص من الطور العضوي واستبداله بالماء، لوحظ عبور الماء إلى الداخل وتفجر المحافظ.
محافظ أو حبيبات البولي ألكيل سيانو أكريلات النانومترية ز/ مNanocapsules ou nanoparticules de polyalkylcyanoacrylate
طريقة التحضير:
- يضاف الموحود إلى الزيت مع التحريك المغناطيسي ثم يضاف الغول المطلق تدريجياً فنحصل على محلول حقيقي.
- يحقن الطور الغولي ضمن الطور المائي الحاوي على عامل فعال على السطح.
- في لحظة المزج يترسب الزيت على شكل قطيرات نانومترية بينما يتكوثر الموحود على سطوح هذه القطيرات ليكون فيلماً رقيقاً وهكذا نحصل على المحافظ النانومترية Nanocapsules.
- بعد التحضير يمكن تركيز المحافظ النانومترية وذلك بتبخير الغول وكمية من الماء باستخدام مبخر دوار تحت ضغط منخفض.
- يمكن أن تضاف المادة الدوائية حسبب انحلاليتها إما إلى الطور الزيتي أو إلى الطور المائي.
- في حال عدم استخدام الزيت نحصل على حبيبات نانومترية Nanoparticules.
مقارنة *الحبيبات النانومترية عبارة عن حبيبات نانومترية غرويدية صلبة، ذات تركيب مستمر يتراوح حجمها بين 10 ــ 1000 نانومتر، تكون فيها المواد الدوائية إما محجوزة أو ممتصة أو مرتبطة. *المحافظ النانومترية عبارة عن محافظ نانومترية غرويدية صلبة تتميز بوجود غشاء خارجي مستمر يتراوح حجمها بين 10 ــ1000 نانومتر تكون فيها المواد الدوائية منحلة أو محجوزة أو مكبسلة أو ممتصة أو مرتبطة.
المصدر
- مقال للدكتور الصيدلاني نذير الخوري فلوح، أستاذ في جامعة دمشق.