الحمى النزفية الفيروسية
| د. محمد أبو شعر |
| المساهمة الرئيسية في هذا المقال |
الحمى النزفية الفيروسية (Viral hemorrhagic fever)
لمحة عامة
الحمى النزفية الفيروسية (VHFs) مجموعة من الأمراض الحَمَوية الناجمة عن فيروسات الحمض النووي الريبي RNA لعدة عائلات فيروسية. تؤدي هذه الفيروسات شديدة العدوى إلى متلازمة مرض قاتل بشكلٍ محتمل تتميز بالحمى، والشعور بالضيق، والتقيؤ، والنزيف المخاطي والنزيف المعدي المعوي (GI)، والوذمة، وانخفاض ضغط الدم.
من المعروف أن أربع عائلات فيروسية تسبب الحمى النزفية الفيروسية عند البشر: Arenaviridae، Bunyaviridae، Filoviridae، وFlaviviridae. يمكن الاطلاع على الخصائص العامة لهذه العائلات الفيروسية في الجدول أدناه.
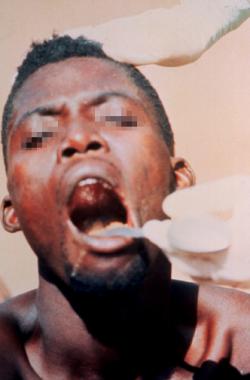
تبين الصورة أدناه حَبَرات حنكية (بقع دموية على الجلد) ونزف عند المريض المصاب بمرض فيروس الإيبولا (EVD).
العائلات الفيروسية المسببة للحمى النزفية الفيروسية
| عائلة الفيروس | المرض (الفيروس) | التوزع الطبيعي | المصدر المعتاد للعدوى البشرية | الحضانة (أيام) |
|---|---|---|---|---|
| Arenaviridae (الفيروسات الرملية) | ||||
| Arenavirus (الفيروسات الرملية) | حمى لاسا | إفريقيا | القوارض | 5-16 |
| حمى نزفية أرجنتينية (Junin) | جنوب أمريكا | القوارض | 4-17 | |
| حمى نزفية بوليفية (Machupo) | جنوب أمريكا | القوارض | 5-19 | |
| حمى نزفية برازيلية (Sabia) | جنوب أمريكا | القوارض | 7-14 | |
| حمى نزفية فنزويلية (Guanarito) | جنوب أمريكا | القوارض | 7-14 | |
| Bunyaviridae (الفيروسات البنياوية) | ||||
| Phlebovirus | حمى الوادي المتصدع | إفريقيا | البعوض | 2-5 |
| Nairovirus | حمى القرم-الكونغو النزفية | أوربا، وآسيا، وأفريقيا | القراد | 3-12 |
| Hantavirus | حمى نزفية مع متلازمة كلوية، متلازمة هانتافيروس الرئوية | آسيا، وأوروبا، وفي جميع أنحاء العالم | القوارض | 9-35 |
| Filoviridae (الفيروسات الخيطية) | ||||
| Filovirus | فيروس ماربورغ وإيبولا | إفريقيا | خفافيش الفاكهة | 2-216 |
| Flaviviridae (الفَيرُوساتُ المُصَفِّرَة) | ||||
| Flavivirus (الفَيرُوساتُ المُصَفِّرَة) | حمى صفراء | إفريقيا الاستوائية، أمريكا الجنوبية | البعوض | 3-6 |
| حمى الضنك النزفية | آسيا، الأمريكتين، إفريقيا | البعوض | غير معروف |
تنتقل الفيروسات الرملية إلى البشر عن طريق التماس بالقوارض وتشمل فيروس لاسا في أفريقيا وعدة حمى نزفية نادرة جنوب أمريكية مثل Machupo، Junin، Guanarito، Sabia.
فيروس لاسا الأهم سريرياً من الفيروسات الرملية، ويمثل معدلات مرضية ووفيات خطيرة في غرب أفريقيا.
ظهرت حمى لاسا لأول مرة في لاسا، نيجيريا، في عام 1969. وقد وجدت في جميع بلدان غرب أفريقيا، وهي مشكلة صحية عامة وهامة في المناطق المتوطنة.
تمثل حمى لاسا 5-14٪ من الأمراض الحميّة في المستشفى. خازنها الطبيعي القوارض الصغيرة حيث تشكل مفرزاتها الحاوية على الفيروس مصدر الانتقال. (انظر الصورة أدناه).

الفيروسات البنياوية (Bunyaviridae)
تشمل هذه المجموعة فيروس حمى الوادي المتصدع (RVF)، وحمى القرم-الكونغو النزفية (CCHF)، والعديد من فيروسات hantaviruses.
فيروسات حمى الوادي المتصدع (RVF) وفيروسات حمى القرم-الكونغو النزفية (CCHF) هي من الفيروسات التي تنقلها المفصليات. ينتقل فيروس حمى الوادي المتصدع (RVF)، (ممرض أفريقي مهم)، إلى البشر والماشية بواسطة البعوض وبواسطة ذبح الماشية المصابة. تُحمل فيروسات حمى القرم-الكونغو النزفية (CCHF) عن طريق القراد وتسبب شكل خاطف وممرض للغاية من الحمى النزفية الفيروسية (VHF) الملاحظة بالانتقال الضبوبي (الهباء الجوي) لجسيماتها المعدية (انظر الصورة أدناه). وقد حدثت فاشيات لحمى القرم-الكونغو النزفية في أفريقيا وآسيا وأوروبا.
ينتشر العديد من فيروسات hantaviruses في جميع أنحاء العالم، مسببة متلازمتين رئيسيتين: الحمى النزفية مع المتلازمة الكلوية (HFRS) والمتلازمة الرئوية المسببة بال hantaviruses (HPS).
تنقسم إلىhantaviruses العالم القديم (مثل فيروس Hantaan النموذجي لكوريا)، والتي تسبب عموماً الحمى النزفية مع المتلازمة الكلوية (HFRS)، وhantaviruses العالم الجديد، المسببة المتلازمة الرئوية (HPS). تحمل القوارض كلا النوعين.
كان فيروس Hantavirus غير المكتشف سابقاً، (Sin Nombre virus)، سبباً في تفشي المتلازمة الرئوية المسببة بال hantaviruses (HPS) الفتاكة للغاية في جنوب غرب الولايات المتحدة في عام 1993. وقد تم تحديد أكثر من 450 حالة في الولايات المتحدة منذ عام 1993، بمعدل وفيات 35٪.
الفيروسات الخيطية (Filoviridae)
أكثر الفيروسات شهرة من فيروسات الحمى النزفية الفيروسية (VHF) فيروس الإيبولا، وفيروس ماربورغ، ينتميان إلى عائلة الفيروسات الخيطية Filoviridae. وقد نشأ كلا الفيروسين في جنوب الصحراء الكبرى الافريقية.
فيروس الإيبولا
تم وصف فيروس الإيبولا (انظر الصورة أدناه) لأول مرة في عام 1976 بعد تفشي الحمى، وأبلغ عن مرض نزفي سريع القتل على طول نهر إيبولا في زائير (الآن جمهورية الكونغو الديمقراطية) والسودان. واستمرت الفاشيات المتفرقة منذ ذلك الوقت، في المناطق المعزولة في وسط أفريقيا. وقد أدى تفشي المرض في كيكويت، وزائير، في عام 1995 إلى 317 حالة مؤكدة، بمعدل وفيات بلغ 81% وكان ثلثا الحالات من العاملين في مجال الرعاية الصحية الذين يقدمون الرعاية للأفراد المصابين. وقد أدى تفشي المرض في اوغندا في أواخر عام 2000 إلى 425 حالة وأودى بحياة 225 شخص.
وقد حدث أكبر تفشي حتى الآن لفيروس الإيبولا في غرب أفريقيا في الفترة من 2014 إلى 2016. وقد حدث هذا التفشي بشكل رئيسي في غينيا وسيراليون وليبريا، بأكثر من 28000 حالة وبأكثر من 11000 حالة وفاة. ونتيجة لهذا التفشي، حدث أيضاً حالات متفرقة لمرض فيروس الإيبولا المستورد من الخارج في الدول الصناعية، بما في ذلك الولايات المتحدة والمملكة المتحدة وإسبانيا وإيطاليا.
يملك الإيبولا خمسة أنواع فرعية متميزة:
Zaire ebolavirus, Sudan ebolavirus, Reston ebolavirus, Taï Forest ebolavirus, and Bundibugyo ebolavirus والعضو الأحدث في هذا الجنس هو Bundibugyo ebolavirus، الذي يبدو أنه مرتبط ارتباطا وثيقاً ب Taï Forest ebolavirus (المعروف سابقاً باسم Côte d'Ivoire ebolavirus)، سميّ باسم مقاطعةBundibugyo في غرب أوغندا.
يسبب Reston ebolavirus المرض عند المُقَدَّمات (أَعْلَى رُتَبِ الثَّدْيِيَّات) غير البشرية والخنازير فقط.
وقد تم تحديد خفافيش الفاكهة كخازن لفيروس الإيبولا.
فيروس ماربورغ
فيروس ماربورغ (انظر الصورة أدناه)، سمي باسم المدينة الألمانية حيث تم الإبلاغ عنه لأول مرة في عام 1967، وهو طرف آخر ممرض للغاية من عائلة الفيروسات الخيطية التي تعزى إلى وسط أفريقيا. وكما هو الحال لفيروس الإيبولا، فمن المرجح أن المضيف الطبيعي للفيروس هو خفافيش الفاكهة. وقد تمت العدوى بفيروس ماربورغ بواسطة مسافر إلى وسط أفريقيا في عام 1987، وكان متوطناً منذ عام 1998 في دوربا، جمهورية الكونغو الديمقراطية، والأشخاص المعرضين في الكهوف أو المناجم.
تم تحديد فيروس ماربورغ على أنه العامل المسبب في تفشي الحمى النزفية عامي 2004-2005 في أنغولا والتي أدت إلى 252 حالة مؤكدة و227 حالة وفاة (90٪ معدل وفيات الحالات). في أواخر عام 2012، أسفر تفشي المرض في أوغندا عن 26 حالة مؤكدة ومحتملة لعدوى فيروس ماربورغ، بما في ذلك 15 حالة وفاة.
الفيروسات المُصفرّة (Flaviviridae)
الحمى الصفراء وحمى الضنك هي الأمراض الأكثر شهرة التي تسببها الفيروسات المصفرّة. كلاهما يُنقل بالبعوض. توجد الحمى الصفراء في أفريقيا الاستوائية وأمريكا الجنوبية، وتوجد حمى الضنك في آسيا وأفريقيا والأمريكيتين. وهما ملاحظتان لما لهما من تأثير واضح على الحملات العسكرية السابقة ولاستمرار وجودهما في جميع المناطق المتوطنة.
تعتبر حمى الضنك الآن الثانية من حيث الأهمية كمرض استوائي بعد الملاريا فقط بسبب ظهورها مجدداً في العقود الثلاثة الماضية. حدثت فاشيات ضخمة عديدة مؤخراً في جميع أنحاء المناطق المدارية، حيث حدثت أشد حالات التفشي في جنوب شرق آسيا ومناطق غرب المحيط الهادئ. الانتقال عن طريق لدغة من بعوض الزاعجة (Aedes) المصابة، ومع ذلك يمكن لحمى الضنك أن تنتقل أيضاً عن طريق نقل الدم.
الفيزيولوجيا المرضية إن الخلل الأساسي بالمرضى الذين يعانون من الحمى النزفية الفيروسية (VHF) هو زيادة نفاذية الأوعية الدموية. لدى فيروسات الحمى النزفية ألفة للجهاز الوعائي، مما يؤدي في البداية إلى علامات مثل الاحمرار، واحتقان الملتحمة، والبثرات النازفة، وعادة ما ترتبط بالحمى والألم العضلي. في وقت لاحق، قد يحدث نزيف واضح للغشاء المخاطي، يرافقه انخفاض بضغط الدم، وصدمة، ووهط دوراني. قد تختلف شدة العرض السريري اعتماداً على الفيروس المسؤول، وكميته، وطريق التعرض.
في المرض الحادة، لدى المرضى تفيرس دم حاد، ووجود للرنا المرسال (mRNA) الدليل على تفعيل السيتوكينات المتعددة. تكشف الدراسات المخبرية أن هذه السيتوكينات تؤدي إلى الصدمة وإلى زيادة نفاذية الأوعية الدموية، وغالباً تُشاهد العمليات الفيزيولوجية المرضية الأساسية في عدوى الحمى النزفية الفيروسية. سمة مرضية بارزة أخرى هي مشاركة البلاعم الواضحة. قد يؤدي عدم كفاية الاستجابة المناعية لهذه المستضدات الفيروسية الجديدة أو تأخرها إلى التطور السريع لتفيرس دم غامر. كما يحدث عدوى واسعة النطاق وتنخر للأعضاء المتضررة. المضاعفات النزفية متعددة العوامل، ومتعلقة بالضرر الكبدي، اعتلال خثري استهلاكي، وإصابة نخاع أولية بالخلايا الضخمة المنواة. تم الإبلاغ عن الانتقال الضبوبي (عن طريق الهباء الجوي) لبعض عداوى الحمى النزفية الفيروسية بين المُقَدَّمات (أَعْلَى رُتَبِ الثَّدْيِيَّات) غير البشرية، وربما هي طريقة الانتقال عند المرضى الذين يعانون من عدوى حادة.
غالبا ما تصاحب المشاركة الوعائية فشل العضو متعدد الأجهزة الذي يؤثر على الأجهزة المكونة للدم، والأجهزة العصبية، والأجهزة الرئوية. تتفاوت المشاركة الكبدية بحسب الكائن الحي المعدي، وتشاهد في بعض الأحيان مع فيروس الإيبولا، وماربورغ، وحمى الوادي المتصدع (RVF) وحمى القرم-الكونغو النزفية (CCHF)، والحمى الصفراء. الفشل الكلوي المصاحب لقلة البول هو سمة بارزة للحمى النزفية المترافقة مع المتلازمة الكلوية (HFRS) المشاهدة في عدوى Hantavirus ويمكن أن تشاهد في الحمى النزفية الفيروسية (VHF) الأخرى حيث يصبح استنزاف الحجم داخل الوعائي أكثر وضوحاً. المضاعفات النزفية واضحة بشكل خاص مع فيروس الإيبولا، وماربورغ، وحمى القرم-الكونغو النزفية (CCHF)، والفيروسات الرملية في أمريكا الجنوبية.
على الرغم من أن الفيزيولوجيا المرضية لعدوى حمى الضنك معقدة وغير مفهومة تماماً، يمكن أن تكون الإصابة بحمى الضنك الشديدة متباينة عن الأشكال الأكثر اعتدالاً من خلال وجود زيادة بنفاذية الأوعية الدموية.
أكبر عامل خطورة لعدوى حمى الضنك الشديدة هي العدوى الثانوية بحمى ضنك بنمطٍ مصلي مختلف عن عدوى حمى الضنك الأولية. يعتقد أن تكون هذه الزيادة بنفاذية الأوعية الدموية ثانوية لتنشيط الخلايا التائية واسعة الانتشار وموت الخلايا المبرمج، ويعتقد أيضاً أن تكون ذات صلة بعملية تُعرف بالتعزيز المعتمد على الأضداد، وأفضل وصف لها أنها التوازن بين التعديل وبين تعزيز الأضداد بعد العدوى الأولية بحمى الضنك، والتي يمكن أن تسهم في شدة عدوى حمى الضنك الثانوية.
معدل الوفيات/المرضية
يتراوح معدل الوفيات بين المرضى المصابين بالحمى النزفية الفيروسية (VHF) لأقل من 10٪ (على سبيل المثال، في حمى الضنك النزفية) إلى ما يصل إلى 90٪، (كما ورد في بعض حالات تفشي الفيروسات الخيطية). وبلغ معدل الوفيات الناجمة عن تفشي فيروس الإيبولا 40٪ في غرب أفريقيا للفترة 2014-2016. تشمل المضاعفات الناجمة عن عدوى الحمى النزفية الفيروسية (VHF) التهاب الشبكية، والتهاب الخصية، والتهاب الكبد، والتهاب النخاع المستعرض، والتهاب القزحية. في المرضى الذين يتعافون من عدوى حمى لاسا، الصَمَم من المضاعفات الأكثر شيوعاً والإجهاض التلقائي شائع أيضاً. ويرتبط القصور الكلوي مع عدوى الحمى النزفية المترافقة مع المتلازمة الكلوية (HFRS).
وفي أعقاب تفشي فيروس الإيبولا في غرب أفريقيا مؤخراً، تم الإبلاغ عن متلازمة ما بعد فيروس الإيبولا، تضمنت ألم عضلي، وألم مفصلي، ومشاكل بصرية بما في ذلك العمى والتهاب القزحية، بالإضافة إلى المشاكل العصبية بما في ذلك مشاكل الذاكرة والخمول والتعب. لوحظ ثبات رنا (RNA) فيروس الإيبولا في عينات السائل المنوي حتى بعد 13 شهر من العدوى، على الرغم من أن التحليل الإحصائي الأخير يشير إلى أن السائل المنوي ل 50٪ من الناجين سيكون خالياً من الإيبولا في غضون 4 أشهر.
وتتراوح فترات الحضانة 2-21 يوم للحمى النزفية الفيروسية (VHF).
الأعراض
تتوافق الأعراض الأولية مع تطور تفيرس الدم وتشمل ما يلي:
- ارتفاع درجة الحرارة
- صداع
- تعب
- ألم بطني
- ألم عضلي
- إعياء
في الأمراض الأكثر تقدماً، تشمل العلامات والأعراض ما يلي:
- إقياء الدم والإسهال المدمى
- نزف الغشاء المخاطي المعمم
- طفح
- الحالة النفسية المتغيرة والوهط القلبي الوعائي (علامات قبل الموت)
العلامات الجسدية
اعتمادا على تقدم المرض، قد يقدم المرضى الذين يعانون من الحمى النزفية الفيروسية (VHF) في البداية علامات بالحد الأدنى، مما يشير إلى متلازمة فيروسية حميدة.
مع تقدم المرض، العلامات الأكثر شيوعاً على النحو التالي:
- حمى
- التهاب البلعوم
- احتقان الملتحمة
- وذمة
- طفح كدمي أو حَبَري
- نزيف الجهاز الهضمي
- انخفاض ضغط الدم و/أو الصدمة
معظم الحمى النزفية، باستثناء حمى الوادي المتصدع، يمكن أن تسبب مجموعة متنوعة من الأعراض الجلدية المسببة بشكل رئيسي بسبب عدم الاستقرار الأوعية الدموية والنزيف غير الطبيعي. وتشمل هذه الأعراض الاحمرار، والحَبَرات (نزيف تحت الجلد)، والفرفرية، والكدمات، والوذمة. إن الفيروسات الرملية (arenaviruses) في العالم القديم التي تسبب حمى لاسا تسبب القدر الأكبر من الوذمة لأياً من فيروسات الحمى النزفية. بالإضافة إلى ذلك، لا يوجد نزوفات غير طبيعية.
تسبب الفيروسات الرملية (arenaviruses) في العالم الجديد (Junin, Machupo, Sabia, and Guanarito) وذمة بشكل أقل وكميات متغيرة من الحَبَرات، والفرفرية، والكدمات، والاحتقان الحنكي، والنزيف المخاطي.
يتبع النزف الأكثر شدة للحمى النزفية الفيروسية العدوى بفيروس الحمى النزفية الكونغو القرم.
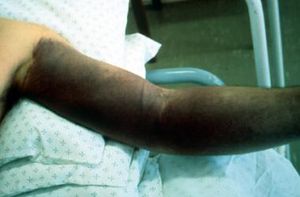
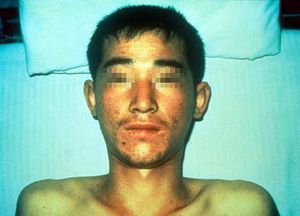
يمكن لفيروسات Hantaviruses أن تسبب طفح مميز نسبياً وطفح حَبَري حول الرقبة وعلى الطيات الأمامية والخلفية الإبطية والذراعين والجذع. يشاهد احمرار يشبه حروق الشمس على الرأس والرقبة وأعلى الصدر والظهر ويمكن أن يرافقه توزم وجهي (انظر الصورة أدناه). في بعض الأحيان، يحدث طفح حصبي الشكل. قد يتطور نزيف حاد فموي ونزيف بالملتحمة.
تبدي الفيروسات الخيطية (ماربورغ وإيبولا) طفح مميز يمكن رؤيته بوضوح عند المرضى ذوي البشرة السليمة. يترافق احتقان الحنك الناعم مع بادئة تشبه الانفلونزا وتتبع بين الأيام الخامس والسابع بطفح غير حاك، مندفع نحو المركز، حطاطي بحجم الدبوس، حمامي. وفي غضون 24 ساعة، يمكن أن يتطور إلى بقع حطاطية ضخمة ومتجمعة، ومحددة الحدود، وأحياناً نازفة. في الحالات الشديدة، ينضح النزف من الأغشية المخاطية، ومواقع بزل الوريد، وفوهات الجسم.
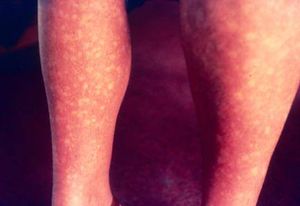
يسبب فيروس حمى الضنك طفح حمامي مميز ببقع ملفتة للنظر جافة (انظر الصورة أدناه).
اعتبارات التشخيص
يجب مراعاة مشاكل أخرى في التشخيص التفريقي والتي تتضمن ما يلي:
- حمى التيفوئيد
- داء الشيغيلات
- انتان الدم بالمكورات السحائية
- العدوى الريكتيسية
- ابيضاض الدم الحاد
- فرفرية نقص الصفيحات الخثارية أو مجهولة السبب
الدراسات المخبرية
يتم إجراء الحد الأدنى من الفحوصات المخبرية اللازمة للتقييم التشخيصي ورعاية المرضى بسبب المخاطر المرتبطة التعامل مع المواد المعدية. الاعتبارات في ترتيب الفحوص المخبرية هي كما يلي:
- غالباً يشير العدّ الدموي الشامل إلى نقص الكريات البيض ونقص الصفيحات (قد لا تكون هذه النتائج موجودة في حمى لاسا)
- تم الإبلاغ عن اضطرابات كهارل واضطرابات استقلابية واضحة في تفشي مرض فيروس الإيبولا مؤخراً، بما في ذلك نقص بوتاسيوم الدم، ونقص كلس الدم، ونقص صوديوم الدم، وارتفاع الكرياتينين وارتفاع فحوة الحماض الأنيوني
- لوحظ ارتفاع أنزيمات ناقلات الأمين الكبدية في الحمى النزفية الفيروسية (VHF) وهي تنبئ بارتفاع معدل الوفيات في عدوى حمى لاسا
- تطاول زمن البروثرومبين (PT)، وزمن الثرومبوبلاستين الجزئي المفعل (aPTT)، ونسبة تخثر الدم (INR)، وزمن التخثر.
قد يكون من المفيد ملف تجلط الدم داخل الأوعية الدموية بما في ذلك مستوى الفيبرينوجين، ومنتجات تدرك الفيبرين، وتعداد الصفيحات.
اختبارات أخرى
لدى معظم المرضى تفيرس دم في وقت العَرَض (باستثناء Hantavirus). يمكن إجراء تشخيص فيروسي محدد باستخدام الاختبارات المصلية، بما في ذلك مقايسة الممتز المناعي المرتبط بالانزيم (ELISA) وتفاعل البوليميراز المتسلسل (PCR). قد تتطلب الحالات الصعبة عزل الفيروس في مزرعة نسيجية. وفي أعقاب تفشي فيروس الإيبولا في غرب أفريقيا عام 2014، ظهر تفاعل البوليميراز المتسلسل باستخدام أنزيم النسخ العكسي (RT-PCR) كأكثر الطرق شيوعاً للكشف عن فيروس الإيبولا في مصل المريض وبالبلازما وبالدم الكامل. كما تم تطوير تقنيات مقايسة الممتز المناعي المرتبط بالانزيم (ELISA) الملتقطة للمستضد استجابة لهذا الفاشية. رعاية قسم الطوارئ إنعاش السوائل والرعاية الداعمة هي الدعائم الأساسية لمعالجة قسم الطوارئ. إن البلورات الوريدية والأكسجين ومراقبة القلب هي الخطوات الأولية الأنسب في علاج المرضى الذين يتوقع إصابتهم بالحمى النزفية الفيروسية (VHF). وتشمل التدابير الأخرى ما يلي:
- تقديم الدم ومنتجات الدم كما هو مبين سريرياً
- تجنب الحقن العضلي واستخدام الأسبرين أو مضادات التخثر الأخرى
- الحد من الإجراءات الغازية بسبب المخاطر المرتبطة بانتقال الفيروس عبر الأجسام الحادة
- الحد من إجراءات توليد الهباء الجوي مثل ضغط مجرى الهواء ثنائي المستوى الإيجابي (biPAP)، والتنبيب، وتنظير القصبات، وتحريض البلغم.
وتشمل تدابير مكافحة العدوى ما يلي:
- وضع المرضى في الغرف المخصصة للمريض الواحد مع حمامه الخاص
- تجنب دخول الموظفين غير الضروريين والزوار، يجب الاحتفاظ بسجل لجميع الأشخاص الذين يدخلون غرفة المريض
- يجب على جميع الموظفين الذين يدخلون الغرفة ارتداء معدات الوقاية الشخصية المناسبة.
المعالجة الدوائية
لم توافق هيئة الاغذية والأدوية الامريكية (FDA) على أية معالجة مضادة للفيروسات أو أي لقاح لعدوى فيروس الايبولا أو ماربورغ. يجب أن تكون المعالجة الداعمة هي التركيز الرئيسي للأطباء الذين يعالجون المرضى المصابين بعدوى فيروسية خيطية مشتبه بها أو مؤكدة، بما في ذلك معالجة نقص حجم الدم، والكهارل، والشذوذات الاستقلابية، وشذوذ الدم، والصدمة، والفشل متعدد الأجهزة، وتخثر الدم داخل الأوعية الدموية.
تم استخدام السوائل الوريدية كبيرة الحجم في إنعاش المرضى المصابين بمرض فيروس الإيبولا (EVD) الذين تم إجلاؤهم من غرب أفريقيا. كما تم استخدام مضادات الميكروبات واسعة الطيف عند المرضى الذين يعانون من صدمة إنتانية مؤكدة.
تم علاج حمى لاسا والحمى النزفية المترافقة مع المتلازمة الكلوية (HFRS) المسببة بعدوى Hantavirus بشكل فعال بالريبافيرين الفموي والوريدي. وبسبب هذا، يوصى بالريبافيرين كعلاج محتمل للفيروسات الرملية الأخرى والفيروسات البياوية. تكون المعالجة أكثر فعالية عندما تعطى في وقت مبكر من المسار السريري. يوصى بالريبافيرين أيضاً للوقاية بعد التعرض. تشمل المعالجات المحتملة الأخرى المضادة للفيروسات ضد حمى لاسا مركبات بنزإيميدازول الجديدة مثل ST-193 وغيرها من المركبات متغايرة الحلقة ذات الصلة.