كربون
الكربون هو عنصر كيميائي من عناصر الجدول الدوري يرمز له بالرمز C، وله عدد ذري 6. وهو من اللا فلزات, رباعي التكافؤ ومنتشر في الطبيعة بعدة أشكال:
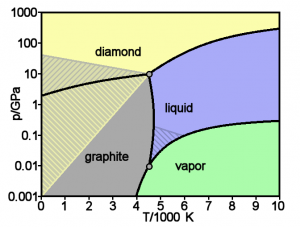
- الماس:أقسى المعادن المعروفة، تتوزع فيه ذرات الكربون على زوايا هرم ثلاثي وذرة كربون في المركز. ترتبط فيه الذرات بتوزيع أربعة إلكترونات في مدارات sp3. مما يشكل بناءا قويا جدا ومترابطا في ثلاثة أبعاد .
- الجرافيت: أحد أكثر المواد ليونة، ترتبط فيه ذرات الكربون بثلاثة إلكترونات، مدار sp2 وإلكترون واحد في مدار s، ويكون شكلها مسطحا في بعدين. مما يشكل ما يشبه الصفائح الممتدة والمتراصة فوق بعضها البعض.
- الفوليرينات: جزيئات كبيرة متكونة من ذرات كربون مترابطة ثلاثيا تعطي شكل كريات (والتي تعتبر أفضل وأبسط الأشكال وتعرف باسم باكي بول).
- السيرافيت: (له سطح ناعم للغاية) لا يعرف تركيب شكله بدقة.
- الأيونسدالايت: (تشوهات من الماس) يماثل الماس في التركيب ولكن ببلورات سداسية.
- الكربون غير المتبلر: تجمعات من جزيئات الكربون في أشكال غير بلورية أو منتظمة, في حالة زجاجية.
- فقاعات الكربون الدقيقة: (شبكة مغناطيسية بالغة الدقة) شبكة قليلة الكثافة شبيهة بالجرافيت, حيث تترابط الذرات ثلاثيا في حلقات سداسية وسباعية.
- أنابيب الكربون الدقيقة: تترابط الذرات ثلاثيا في رقائق منحنية تشكل إسطوانات مفرغة.
المصابيح السوداء تتكون من مناطق جرافيت صغيرة. وهذه المناطق تكون موزعة عشوائيا, بحيث إن البناء الكلي يكون متماثلا.
الكربون الزجاجي متماثل الخواص) ويحتوى على نسبة عالية من المسامات المغلقة. وبعكس الجرافيت العادي, فإن الطبقات الجرافيتية ليست متراصة مثل الصفحات في كتاب ما, ولكن لها ترتيب عشوائي.
الألياف الكربونية تشبه الكربون الزجاجي. وتحت ظروف المعاملة الخاصة (شد الألياف الكربونية وكربنتها) فإنه يمكن ترتيب أسطح الكربون في إتجاه الألياف. وبالتعامد على محور الألياف لا يوجد توجيه لأسطح الكربون. وتكون الألياف الناتجة ذات قوة شد أكثر من الحديد.
يتواجد الكربون فى كل أشكال الحياة العضوية وهو أساس الكيمياء العضوية. كما أن هذا اللا فلز له القدرة على الاتحاد مع نفسه وعدد كبير من العناصر الأخرى, لإنتاج ما يقرب من 10 مليون مركب معروف. يتحد مع الأكسجين لتكوين ثاني أكسيد الكربون وهو مركب حيوي لنمو النبات. وعند اتحاده مع الهيدروجين, فإنه ينتج عديد من المركبات تسمى الهيدروكربونات, وهذه المركبات مهمة في الصناعات المختلفة كصناعة الوقود العضوي. وعند اتحاده مع كل من الأكسجين والهيدروجين فإنه ينتج مجموعات عديدة من المركبات منها الأحماض الدهنية, وهذه الأحماض أساسية للحياة, والإسترات التي تعطى النكهة لعديد من الفواكه. كما أن نظير الكربون كريون-14ٍٍ يستخدم في تحديد الزمن إشعاعيا.
الصفات المميزة
الكربون عنصر مميز لأسباب عديدة. تتضمن أشكاله العديدة مادة من أنعم المواد (الجرافيت) ومادة من أقسى المواد (الماس). كما أن لها قابلية كبيرة للترابط مع الذرات الأخرى الصغيرة, بما فيها ذرات الكربون نفسه, وحجمه الصغير يجعله يستطيع تكوين روابط عديدة. ونظرا لذلك فإن الكربون يعرف أنه يكون ما يقرب من 10 ملايين مركب, أى معظم المركبات الكيميائية تقريبا. مركبات الكربون هى الأساس للحياة على الأرض كما أن دورة كربون-نيتروجين هى السبب فى إصدرا بعض الطاقة الصادرة من الشمس والنجوم الأخرى.
لم يتكون الكربون خلال الإنفجار العظيم لأنه يتطلب تجمع ثلاثي لجسيمات ألفا (نواة الهيليوم) حتى ينتج. وفى الأصل تمدد الكون ثم برد بسرعة كبيرة حتى أصبح ذلك ممكنا. وبصفة عامة فإن الكربون أنتج فى داخل النجوم بداخل الفرع الأفقي. كما انه أنتج أيضا فى حالة عديدة الذرات.
الإستخدامات
الكربون مكون أساسي لكل الأنظمة الحية, وبدونه لا يمكن أن تتواجد الحياة كما نعرفها (شاهد أحياء اللا كربون).الهيدروكربونات هى أكثر الإستخدامات الإقتصادية للكربون, وأكثرها شيوعا الوقود العضوي, مثل غاز الميثان والنفط (البترول). يتم تطبيق تقنيات الصناعة النفطية على النفط الخام لإنتاج عديد من المركبات منها البنزين والكيروسين, خلال عمليات التقطير, فى معامل التكرير. كما أن النفط الخام يعتبر المادة الأولية لعديد من المواد التصنيعية, ومنها اللدائن.
إستخدامات أخرى للكربون
- يستخدم النظير كربون-14 والذى أكتشف فى 27 فبراير عام 1940 فى تحديد الزمن إشعاعيا.
- بعض مكتشفات الدخان تستخدم كميات ضئيلة من نظائر الكربون النشيطة إشعاعيا كمصدر إشعاع تأيين (كثير من المكتشفات من هذا النوع تستخدم نظائر الأمريكيوم.
- يتم خلط الجرافيت مع الطين لإنتاج "الرصاص" المستخدم فى الأقلام الرصاص.
- يستخدم الماس كحلي, وأيضا يستخدم فى أسنان المثقاب, كما أن كثير من التطبيقات تستفيد من صلابته.
- يضاف الكربون إلى الحديد لإنتاج الصلب.
- يستخدم الكربون كمهدئ نيترون فى المفاعلات النووية.
- يتم سحق الجرافيت, وعمل قوالب منه تستخدم كفحم فى الطبيخ, الأعمال الفنية وإستخدامات أخرى.
- تستخدم أقراص الفحم فى الطب فى شكل أقراص أو مسحوق لإمتزاز المواد السامة من الجهاز الهضمي.
الخواص الكيميائية والبنائية للفوليرينات (fullerenes), فى شكل أنبوبة كربون دقيقة, يمكن أن تساعد فى المجال الجديد تقنية النانو, وعموما فإن النانو جسيمات من المكن أن تكون سامة.
تاريخ الكربون
الكربون ("كربو" تعني باللغة اللاتينية "فحم") تم إكتشافه فى عصور ما قبل التاريخ وكان معروف عند القدماء, الذين حصلوا عليه بحرق المواد العضوية بمعزل عن الاكسجين لتصنيع الفحم. كما أن الماس يعتبر منذ القدم من المواد النادرة. ومن الصور الأخيرة المكتشفة لتآصلات الكربون فوليرين, والتى تم إكتشافها كمنتج ثانوي أثناء تجارب الشعاع الجزيئي فى الثمانينات من القرن العشرين.
صور تآصل الكربون
تآصل الكربون النقي يختلف عن تآصل التركيبات الجزيئية الأخرى له.
الثلاث تآصلات المعروفة للكربون هم الكربون الغير متبللر, والجرافيت. والماس. كما تم تصنيع وإكتشلف عدد من ثور التآصل الشاذة الأخرى ومنها الفوليرينات, أنابيب الكربون الدقيقة, واللونسداليت.
فى شكله الغير متبللر, يكون الكربون فى الأساس جرافيت ولكن لا يتواجد فى شكل متبللر كبير. ولكن يتواجد فى شكل مسحوق والذى يكون المكون الرئيسي للمواد مثل الفحم, السناج, سخام, كربون منشط.
فى الضغط العادى يأخذ الكربون شكل الجرافيت, وفيه ترتبط كل ذرة مع ثلاث ذرات فى مستوى يتكون من شكل سداسي فى كل الحلقات. مثل الحلقات الموجودة فى الهيدروكربونات الأروماتية. الشكلان المعروفان للجرافيت, ألفا (سداسي) و بيتا (منشور سداسي منتظم), وكلاهما له خواص فيزيائية متطابقة, فيما عدا البناء البللوري. ويحتوى الجرافيت الذى يتواجد بصورة طبيعية على 30 % تقريبا من الشكل بيتا, وعند تصنيع الجرافيت فإنه يحتوى فقط على الشكل ألفا. ويمكن للشكل ألف أن يتحول إلى الشكل بيتا بالمعالجة الميكانيكية ويرجع الشكل بيتا إلى الشكل ألفا عند تسخينه فوق 1000 C °
وبسبب عدم تمركز سحابة-باي, فإن الجرافيت يوصل الكهرباء. الجرافيت مادة طرية ورقاقتها, تفصل كتيرا بالذرات الأخرى, وتمسك مع بعضها البعض عن طريق قوى فان دير فال, وبالتالى فإنها تنزلق بسهولة على بعضها البعض.
وفى الضغوط العالية يكون الكربون صورة من صور تآصله تسمى الماس, والتى ترتبط فيها كل ذرة لأربعة ذرات أخرى. وللماس نفس البناء المكعب للسيليكون والجيرمانيوم, ونظرا لقوة الرابطة بين كربون-كربون, فإنه مع نيتريد البورون متساوي الإلكترونات (BN) أقصى المواد من حيث مقاومة الخدش. التحولات التى تحدث للجرافيت فى درجة حرارة الغرفة بطيئة للغاية لأن تلاحظ. وتحت بعض الظروف, يتبللور الكربون لللونسدالايت وهو شكل مشابه للماس ولكن سداسي.
الفوليرينات لها بناء يماثل الجرافيت, ولكن بدلا من الشكل السداسي النقي, فإنها تحتوى على أشكال خماسية (وإحتمال سباعية) من ذرات الكربون, مما يؤدى لإنثناء الطبقات إلى كريات أو إسطوانات. خواص الفوليرينات (تسمى أيضا "كرة بوكي" و "أنبوبة بوكي") لم يتم تحليلها حتى الأن. وكل أسماء الفوليرينات تم تسميتها على شرف بوكوينستر فوللير, مطور قبة جيوديسي والتى تسبه بناء كرة بوكي.
تآصل فقاعة دقيقة تم إكتشافه مؤخرا وهو مغناطيسي حديدي.
صور الكربون المتآصلة تتضمن:
- الكربون الغير متبللر
- فقاعة كربون دقيقة تم إكتشافه عام 1997
- أنبوبة كربون دقيقة
- الماس
- فوليرين
- جرافيت
- أيونسدالايت
- سيرافيت
نظام تآصل الكربون يتسع لمدى كبير للغاية.
بين الماس والجرافيت:
- الماس أصلب المعادن المعروفة للإنسان, ولكن الجرافيت أيضا من أكثرها طراوة.
- الماس مادة كاشطة, بينما الجرافيت مادة مزيتة.
- الماس عازل ممتاز للكهرباء,بينما الجرافيت يوصل الكهرباء.
- الماس غالبا شفاف, بينما الجرافيت معتم.
- الماس له شكل بللوري مكعب, بينما الجرافيت شكله البللورى سداسي.
بين الكربون الغير متبللر والأنابيب الدقيقة:
- الكربون الغير متبللر هو من أسهل المواد التى يمكن تصنيعها, بينما كربون الأنابيب الدقيقة يحتاج لنفقات باهظة لتصنيعه.
- الكربون الغير متبللر موحد الخواص, ولكن كربون الأنابيب الدقيقة من ضمن أكثر المواد المتباينة الخواص على الإطلاق.
التواجد
يوجد تثريبا 10 ملايين من المركبات المعروفة للكربون, وألاف منها أساسي للحياة وفى غاية الأهمية الإقتصادية. وهذا العنصر وفير فى الشمس والنجوم والمذنبات وفى غلاف معظم الكواكب. كم أن بعض النيازك تحتوى على ماسات مجهرية تكونت عندما كان النظام الشمسي لايزال قرص كوكب أول. وبالإتحاد مع العناصر الأخرى, فإن الكربون يوجد فى الغلاف الجوي, ويوجد أيضا كمادة مذابة فى كل الأجسام المائية. وبكميات قليلة من الكالسيوم, والماغنسيوم, والحديد, فإنه المكون الأساسي فى الكربونات, والصخور (الحجر الجيري, والدولميت, والرخام وهكذا). وعند إتحاده مع الهيدروجين, يكون الكربون الفحم, والنفط, والغاز الطبيعي ويطلق عليهم هيدروكربونات.
يوجد الجرافيت بكميات كبيرة فى نيو يورك وتكساس بالولايات المتحدة, كما يوجد أيضا فى روسيا, والمكسيك, وجرين لاند, والهند.
الماس الطبيعي يوجد فى الصخر البركاني كيمبرليت الذى يوجد فى إمتدادات وفوهات البراكين القديمة. ومعظم نرسبات الماس توجد فى أفريقيا, وخاصة جنوب أفريقيا, ناميبيا, بتسوانا, جمهورية الكونغو. كما يوجد أيضا فى القطب الشمالي الروسي, البرازيل, وشمال وغرب أستراليا.
المركبات العضوية
(شاهد المقالة الرئيسية الكيمياء العضوية)
أشهر أكاسيد الكربون على الإطلاق هو ثاني أكسيد الكربون CO2. وهو عنصر قليل من مكونات الغلاف الجوي, ويتم إنتاجه وإستهلاكه عن طريق الكائنات الحية. ويقوم ثانى أكسيد الكربون بتكوين حمض الكربونيك (H2CO3) بكميات قليلة فى الماء, ولكن مثل معظم مركبات الكربون التى يكون بها كثير من الروابط الأحادية على مع الأكسجين على ذرة كربون واحدة فإنه لا يكون ثابت. وعلى هذا فإنه يكون هناك حالات وسيطة, وخلال هذه الحالات الوسيطة تنتج أيونات الكربونات. وهنام كثير من الأملاح على هيئة كربونات, ومن اهمها الكالسيت. ثانى كبريت الكربون CS2 أيضا من الكربونات المهمة.
ومن الأكاسيد الأخرى أول أكسيد الكربون CO, والأكسيد الغير عادي للكربون C3O2. يتكون أول أكسيد الكربون بالإحتراق الغير كامل, وهو عديم اللون, والرائحة. وتحتوى هذه الجزيئات التى تحتوى على رابطة ثلاثية وهى جزيئات قطبية إلى حد ما, مما يؤدى لميلها للإرباط بجزيء الهيموجلبين, وعلى هذا فإن أول أكسيد الكربون من الغازات السامة. السيانيد CN-, له بناء مماثل ويتصرف مثل أيون الهاليدات, النيتريد (السيانوجين) (CN)2 أيضا متضمن فى ذلك.
ومع الفلزات القلوية يكون الكربون إما الكاربيدات C-, أو أسيتيليدات C22-, وهذه تكون مع الميثان والأسيتيلين, وكلاهما حمض ضعيف. وكلهم له سالبية كهربيية 2.5, مثل الكاربوروندوم SiC, الذى يشبه الماس.
سلاسل الكربون
تتكون الهيدروكربونات من سلاسل من ذرات الكربون, مشبعة بذرات الكربون. وتكون الزيوت المتطايرة لها سلاسل قصيرة. بينما الدهون لها سلاسل أطول, والشمع له سلاسل أكثر طولا.
دورة الكربون
لمزيد من التفاصيل راجع دورة الكربون
فى الظروف العادية من النادر تحول نظير من نظائر الكربون للأخر. وعلى هذا, فإنه ولهدف معين فإن نسبة الكربون. وعلى ذلك فإن العمليات التى تستهلك الكربون يجب أن تحصل عليه من مصدر أخر, وتتخلص منه فى مكان أخر. والطرق التى يسلكها الكربون فى الطبيعة تسمى دورة الكربون. فمثلا, تسحب النباتات الكربون من الهواء فى صورة ثناى أكسيد الكربون وتستخدمه لبناء نفسها. وبعض هذه النباتات تؤكل عن طريق الحيوانات, التى يتنفس بعضها ويطلق ثانى أكسيد الكربون. ودورة الكربون معقدة وليست بسيطة كما قد يبدو فى هذا المثال البسيط, فمثلا يذوب بعض ثانى أكسيد الكربون فى المحيطات, كما ان النباتات والحيوانات الميتة يمكن أن تتحول إلى أحجار رسوبية, وهكذا.
النظائر
للكربون نظيرين طبيعيين مستقرين هما كربون-12 او 12C ويشكل 98.89% من مجموع الكربون في الطبيعة والنظير كربون-13 او 13C والذي يشكل 1.11% كما ان للكربون نظير غير مستقر يظهر في الطبيعة هو الكربون-14 او14C . يوجد 15 نظير معروف للكربون وأقلهم عمرا 8C الذى يضمحل عن طريق إنبعاث بروتون وإضمحلال ألفا. وله فترة عمر نصف تبلغ 1.98739x10-21 ثانية.
في عام 1961 قام الاتحاد الدولي للكيمياء المجردة والتطبيقية ([IUPAC]) ، بتبنى النظير كربون-12 كأساس لقياس الكتل الذرية.
للكربون-14 له عمر نصف مقداره 5715 عام، وهو يستخدم بشكل كبير لقياس تحديد الزمن إشعاعيا للأخشاب ، علم الآثار، الحفريات.
الإحتياطات
الكربون أمن نسبيا. ولكن إستنشاق السخام بكميات كبيرة يمكن أن يكون خطر. ويمكن للكروبن أن يشتعل فى درجات الحرارة العالية للغاية ويحترق بشدة كما فى حريق ويندسكال.
ونظرا لوجود عدد هائل من مركبات الكربون, بعضها سام للغاية مثل سيانيد CN-, وبعضها أساسي للحياة مثل ديكستروز, ويعضها يمكن يكون الإثنين معا مثل ثناني أكسيد الكربون CO2.
الإستخدامات
الكربون مركب ضروري لكل الكائنات الحية المعروفة، وبدونه لم يكن للحياة بالشكل الذي نعرفه ممكنه . الاستخدام الاقتصادي الرئيسي للكربون هو عندما يكون على شكل مركبات هيدروكربونية، من اوضح الامثلة الوقود الاحفوري ، غاز الميثان والنفط الخام، والنفط الخام يستخدم في صناعة البتروكيماويات لانتاج البنزين ، زيت الديزل والكاز ، وذلك عن طريق عملية تقطير مرحلية . كما يشكل النفط المادة الخام التي تصنع منها العديد من المواد الصناعية والتي تشكل اللدائن (البلاستيك) جزءا كبيرا منها .
إستخدامات اخرى
|
الخواص الكيميائية والبنائية للفوليرينيس (احد اشكال الكربون)، والتي تكون على شكل انابيب متناهية الدقة (تقاس بالنانومتر) مؤهلة للإستخدام في التكنولوجيا المتناهية الصغر ( تكنولوجيا النانو ) الناشئة.
شاهد أيضا
المراجع
- الجرافيت فى درجات الحرارة العالية والضغط العالي وتم حثه بإمتصاصشعاع LHC , J.M. Zazula, 1997
- WebElements.com andEnvironmentalChemistry.com per the guidelines atWikiProject Elements
وصلات خارجية
- معمل لوس ألاموس القومي - كربون
- مقالة عن الطبيعةمقالة عن الطبيعة
- العناصر على شبكة المعلومات -كربون
- إنه أساسي:الكربون
- – الكربون والفوليرين وصور اخرى متآصلة - ڤنسنت هر
- صفحة ممتدة للكربون فى موقع asu.edu
الجدول الدوري
| |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
af:Koolstof ast:Carbonu bg:Въглерод bn:কার্বন ca:Carboni co:Carboniu cs:Uhlík cy:Carbon da:Carbon de:Kohlenstoff el:Άνθρακας en:Carbon eo:Karbono es:Carbono et:Süsinik eu:Karbono fa:کربن fi:Hiili fr:Carbone gd:Gualan gl:Carbono (elemento) gu:કાર્બન he:פחמן hr:Ugljik hu:Szén hy:Ածխածին ia:Carbon (elemento) id:Karbon io:Karbo is:Kolefni it:Carbonio ja:炭素 jbo:tabno ko:탄소 la:Carbonium lb:Kuelestoff li:Koolstof lmo:Carbòni ln:Kaboni lt:Anglis lv:Ogleklis mi:Waro mk:Јаглерод ml:കാര്ബണ് ms:Karbon nds:Kohlenstoff nl:Koolstof nn:Karbon no:Karbon (grunnstoff) nov:Karbo oc:Carbòni pl:Węgiel (pierwiastek) pt:Carbono qu:K'illimsayaq ro:Carbon ru:Углерод sh:Ugljenik simple:Carbon sk:Uhlík sl:Ogljik sq:Karboni sr:Угљеник su:Karbon sv:Kol ta:கரிமம் tg:Карбон th:คาร์บอน tl:Karbon tr:Karbon ug:كاربون uk:Вуглець uz:Uglerod vi:Cacbon wa:Carbone zh:碳 zh-min-nan:C (goân-sò͘) zh-yue:碳