محلول منظم
المحلول المنظِّم هو محلول كيميائي يُقاوِم أيّ تغيير في تركيز أيون الهيدرونيوم وأيون الهيدروكسيد، عند إضافة كميات قليلة من حمض قوي أو قاعدة إليها، أو عند تخفيف المحلول. وبذلك «يُنظّم» أيْ يُحافظ على درجة الحموضة (الرقم الهيدروجيني) عند (أو قريبًا من) قيمة ثابتة. يتكون المحلول المنظم من خليط لحمض ضعيف وأحد أملاحه أو خليط لقاعدة ضعيفة وأحد أملاحها.
يتكون محلول منظم من مخلوط تتغير فيه قيمة الباهاء pH قليلا عند إضافة حمض أو قاعدة إليه ، أي يكون تغير الباهاء في المحلول المنظم أقل من تغيره في حالة عدم كونه محلولا منظما. وينشأ عمل المحلول المنظم من تفاعل أيونات أكسونيوم (H3O+) المضافة مع حمض إلى حمض ضعيف ، أو تفاعل ايون هيدروكسيد (OH−) المضافة بواسطة إضافة قاعدة إلى قاعدة ضعيفة والتي لا تميل إلى إنتاج أيونات أوكسونيوم أو أيونات هيدروكسيد بنفسها على التوالي.
تنتج المحاليل المنظمة في الكيمياء باستخدام محلول مائي منظم. كما يوجد في جسم الإنسان والحيوان محاليلا منظمة معقدة التركيب طبيعيا في الدم ، كما يوجد منها في المياه الباطنية التي تختلط بالدبال.
الأساس الكيميائي للمحلول المنظم
تحتوي المحاليل المنظمة على مخلوط من حمض ضعيف وقاعدته القرينة (المنتسبة إليه ، مثل أحد أملاحه) أو تتكون المحاليل المنظمة من مخلوط لقاعدة ضعيفة وحمضها المرافق . وكذلك توجد ما يسمى "أمفوليت " ampholyte وهي جزيئات ذات وظيفة ثنائية يمكن أن تكوّن محلولا منظما.
وما يحدد قيمة الباهاء pH لمحلول منظم هو توازن الانتقال البروتوني لزوج المحلول المنظم.
في حالة توازن حمض HA يكون:
ووفقا ل قانون فاعلية الكتلة كان من المفروض أن يكون تركيز الماء في بسط الكسر في المعادلة. ولكن نظرا لكون تركيز الماء كبير جدا (6 و55 مول/لتر) بالمقارنة بتركيز الأيونات فيمكن اتخاذ تركيز الماء كثابت وهي من ضمن ثابت الانحلال Ks .
وبإعادة تشكيل المعادلة نحصل على :
ومنها نحسب اللوغاريتم العشري السالب ، فنحصل على :
وهذا يؤول إلى :
وبالتالي :
- وهي تسمى (معادلة المحلول المنظم) أو معادلة هندرسون-هاسلبالخ.
بواسطة تلك المعادلة - حيث تساوي الفاعلية الكيميائية للمواد تركيزاتها - يمكننا حساب نسب تركيزي الحمض والقاعدة عند أي قيمة للباهاء pH إذا كانت قيمة pKs معروفة.
وكلما زادت التركيزات كلما انخفض تأثير إضافة حمض أو قاعدة. وكمية قاعدة قوية (أو حمض) يمكن لمحلول منظم أخذها من دون أن تغير الباهاء له تغيرا كبيرا فيعبر عنها بما يسمى سعة محلول منظم.
ومن أمثلة المحاليل المنظمة : محلول حمض الخليك/أسيتات أو محلول الأمونيا المنظم ، وهو يتكون من أيونات الأمونيا والأمونياك.
قدرة التنظيم
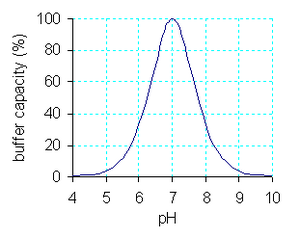
قدرة التنظيم هي قياس كمي لمقاومة المحلول المنظم لتغير باهاء المحلول بإضافة أيونات الهيدروكسيل. ويمكن تعريفها كما يلي:
- قدرة التنظيم =
حيث dn هي التغير في كمية القاعدة المضافة ، و(d(pH هو التغير المتناهي في الصغر للباهاء. باستخدام هذا التعريف يمكن التعبير عن قدرة التنظيم كالتالي[1]:
حيث Kw هو ثابت التأين الذاتي (en) للماء و CA هو التركيز التحليلي للحمض ، ويساوي [HA]+[A-].
العبارة [ Kw/[H+ تصبح معتبرة عند باهاء أكبر من 11,5 والعبارة الثانية تصبح معتبرة عندما يكون الباهاء أقل من 2. كلتا هاتين العبارتين هي من خصائص الماء ومستقلة عن الحمض الضعيف. بالنسبة للعبارة الثالثة نستنتج أن:
- تصل قدرة التنظيم للحمض الضعيف قيمتها العظمى عندما pH = pKa
- عند pH == pKa ± 1 تهبط قدرة التنظيم إلى 33% من القيمة العظمى. وهذا هو المجال التقريبي الذي يعمل ضمنه التنظيم بالحمض الضعيف بفعالية. ملاحظة: عند pH == pKa - 1 تبين معادلة هندرسون-هاسلبالخ (en) أن النسبة [HA]:[A-] هي 10:1.
- تتناسب قدرة التنظيم مباشرة مع التركيز التحليلي للحمض.
الأنواع
ينظم محلول منظم من الكربونات (مخلوط حمض الكربونيك وبيكربونات) تركيز ثاني أكسيد الكربون CO2-في الجو وفي المحيطات وفي الغلاف الحيوي للأرض. وهو يشكل أيضا الحزء الرئيسي في محلول منظم الدم. وهو يحافظ على أن يكون الأس الهيدروجيني (باهاء pH) بين 35 و7 و45 و7 ، ويعادل تغيراته بسبب عملية التمثيل الغذائي.
عندما تكون قيمة pH في الدم أقل من 35 و7 تسمى ذلك "حماض (طب)" وعندما تكون قيمته أعلى من 45 و7 فتسمى تلك الحالة "قلاء". ويتسبب في الموت عند قيمة pH تحت 8 و6 أو أعلى من 0 و8.
تصنف المحاليل المنظمة إلى قسمين : محلول منظم مغلق ، ومحلول منظم مفتوح. (مثل محلول منظم من حمض الخليك/ أسيتات) تمتص البروتونات (H+) أو أيونات هيدروكسيد (OH−) الناشئة من تفاعل كيميائي في المحلول المنظم. وتتفاعل لتكوين حمض مقترن أو قاعدة المنظم وتبقى في المحلول. أما في حالة المحلول المنظم المفتوح (مثل محلول منظم من بيكربونات/ثاني أكسيد الكربون في الرئة) فيكون النظام في خالة تبادل مع الهواء. فيكون قادرا على أعظاء مركبات إلى الهواء بحيث ينضبط pH ، مثل خروج ثاني أكسيد الكربون CO2 أثناء التنفس مع الزفير.
استخدامات
وللمحاليل المنظِّمة عدد كبير من التطبيقات الكيميائية. فمثلًا تزدهر العديد من الكائنات الحية فقط إذًا كانت ضمن مجال محدد صغير من درجة الحموضة، ولذا فالدم مثلًا محلول منظم.
وجود المحاليل المنظمة ضروري لضمان الانتظام الفيزيائي لعمل أجهزة الأجسام الحية وسير العمليات الحيوية فيها. فمثلا في جسم الإنسان تحتوي العصارة المعدية على محاليل منظمة ذات حمضية قوية فيها تساوي 1.4 وهي تقارن بحمضية محلول من حمض الهيدروكلوريك، هذه الحمضية العالية مهمة جدًا في عملية حلمهة البروتونات لأن جزيئاتها كبيرة ولا يمكن لجدران الأمعاء امتصاصها، أما جزيئات الأحماض الأمينية الناتجة فتستطيع أن تنفذ عبر جدران الأمعاء ويمكن امتصاصها بواسطة التيارات الدموية. كما أنها ضرورية في تحضير أطعمة أمينية وأنواع الشراب وفي تحضير التربة الملائمة لنمو المحاصيل إضافة إلى أهميتها في الأغراض الكيميائية والصناعية المختلفة وفي البحث الطبي.
ومن الأمثلة على المحاليل المنظمة، مزيج من محلول حمض الخل وخلات الصوديوم، فعند إضافة كمية من حمض قوي لهذا المحلول تتحد أيونات الأوكسونيوم مع أيونات الخلات لتكون حمض الخليك، أما عند إضافة كمية من محلول قاعدي فتتحد أيونات الهيدروكسيد مع حمض الخليك لتكون أيونات الخلات)أسيتات).
- الحفاظ على قيمة الأس الهيدروجيني للدم لكي تبقى في الحيز السليم.
- ترسيب بعض المواد
- جلفنة
- دباغة الجلود
أمثلة
- نظام حمض الكربونيك والبيكربونات (pH 6,2 - 8,6; متعادل)
- نظام حمض الكربونيك والسيليكات (pH 5,0 - 6,2; حمضي ضعيف)
- محلول حمض الخليك/أسيتات (pH 3,7 - 5,7)
- محلول منظم الفوسفات (فوسفات أحادية الصوديوم NaH2PO4 + فوسفات ثنائية الصوديوم) (pH 5,4 إلى 8,0)
- محلول منظم الأمونيا: NH3 + H2O + NH4Cl (pH 8,2 - 10,2)
المصادر
- ↑ Hulanicki, A. (1987). Reactions of acids and bases in analytical chemistry. Horwood. ISBN 0853123306. (translation editor: Mary R. Masson)
انظر أيضا
- محلول منظم الدم
- قطب الباهاء
- محلول حمض الخليك/أسيتات
- أس هيدروجيني
- مؤشر الأس الهيدروجيني
- تفاعل حمض-قاعدة
- محلول حمض الخليك/أسيتات
- جلفنة
- محلول حمض الكربونيك/بيكربونات
- أيون الهيدروجين







![{\displaystyle \mathrm {{\frac {dn}{d(pH)}}=2.303\left({\frac {{\mathit {K}}_{w}}{[H^{+}]}}+[H^{+}]+{\frac {C_{A}{\mathit {K}}_{a}[H^{+}]}{\left({\mathit {K}}_{a}+[H^{+}]\right)^{2}}}\right)} ,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ddb15528a05f88c0b3017dc9338505206d703bdc)