الفرق بين المراجعتين لصفحة: «كتيلة الدنا»
ط (مراجعة واحدة) |
(لا فرق)
|
المراجعة الحالية بتاريخ 16:05، 5 نوفمبر 2013
| هذه المقالة يتيمة إذ لا تصل إليها مقالة أخرى. ساعد بإضافة وصلة إليها في مقالة متعلقة بها. (فبراير_2011) |
كتيلة الدنا وتعرف أيضا بالكتيلة المنزلقة هي بروتين مطوي يخدم كعامل محفز للتقدمية (بالإنجليزية: Processivity) في عملية تضاعف الدنا. بما أن بروتين الكتيلة هو عنصر حرج في دنا بوليميراز 3 هولوإنزيم (بالإنجليزية: DNA polymerase III holoenzyme) فإنه يقوم يربط بوليميراز الدنا مما يمنع الإنزيم من التفكك من خيط الدنا القالب. إن تفاعلات البروتين-بروتين البوليميرازية الكتيلية هي أقوى وأكثر تحديدا من التفاعلات المباشرة بين البوليميرزات وخيط الدنا القالب ويزيد حضور الكتيلة المنزلقة من عدد النيوكليوتيدات التي يمكن للبوليميراز أن يضيفها إلى الخيط المتنامي لكل حدث ترابط يحصل. إن وجود كتيلة الدنا يمكن أن يزيد من معدل تخليق الدنا إلى 1,000 طية مقارنة بالبوليميرات غير التقدمية.
| وحيدات بيتا مع بلمرة دنا ثلاثية | |
|---|---|
 | |
| Identifiers | |
| Symbol | dnaN |
| Entrez | 948218 |
| PDB | 1MMI (RCSB PDB PDBe PDBj) |
| UniProt | P0A988 |
| Other data | |
| EC number | 2.7.7.7 |
التركيب
إن طية كتيلة الدنا هي عبارة عن بروتين ألفا+بيتا والتي تتجمع في بنية متعددة القسيمات التي تطوّق لولب الدنا المزدوج كما يضيف البوليميزر نيوكليوتيدات إلى الخيط المتنامي. تتجمع كتيلة الدنا عند شوكة التضاعف في الدنا وتنزلق عبر الدنا مع البوليميزر المتقدم، بمساعدة من طبقة من جزيئات الماء في المسام الوسطية للكتيلة بين الدنا وسطح البروتين. توجد طية كتيلة الدنا في كل من بدائيات النواة وحقيقيات النواة.
تكون الكتيلة من نوع بيتا في بدائيات النوى متثانية (جزيء مثنوي) أما في حقيقيات النوى فهي ثلاثية وبسبب الشكل الحلقي لعديد الوحدات المجمّعة، لا يمكن أن تنفصل الكتيلة من خيط القالب بدون التفكك إلى مونميرات.
تجميع كتيلة الدنا
يتم تحميل الكتيلات المنزلقة داخل خيوط قالب الدنا المترافقة عن طريق بروتينات مخصوصة معروفة بمحملات الكتيلة المنزلقة؛ والتي تفكك الكتيلات بعد انتهاء التضاعف. تتداخل مواقع الارتباط لبروتينات الابتداء هذه مع مواقع الربط لبولميريزات الدنا ولذا فإن الكتيلة لا يمكن لها أن تترافق مع محملات الكتيلة والبولميزير معا. ويهذا لا تتفكك الكتيلة بينما تبقى البوليميراز مترابطا. على الرغم من أن كتيلات الدنا تلعب دورا اقل أهمية في الترابط مع بروتينات الدنا المتفاعلة الأخرى. مثل عوامل تجمع النيوكليوسومات (الجسيم النووي) وإنزيمات الربط (بالإنجليزية: Ligases) وشظايا أوكازاكي وبروتينات ترميم الدنا، فكل هذه البروتينات تتقاسم موقع ربط على كتيلة الدنا والتي تتداخل مع موقع محملات الكتيلة، مما يؤكد أن الكتيلة لن تتم إزالتها بينما لا يزال أي إنزيم يعمل على الدنا. يتطلب نشاط محملات الكتيلة تحلل أدينوسين ثلاثي الفوسفات (بالإنجليزية: ATP hydrolysis) لإغلاق الكتيلة حول الدنا.
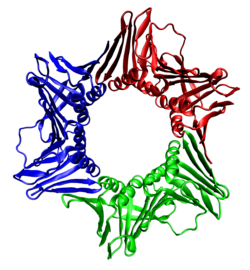
| مستضد تكاثر الخلية النووية | |
|---|---|
 | |
| Identifiers | |
| Symbol | PCNA |
| Entrez | 5111 |
| HUGO | 8729 |
| OMIM | 176740 |
| PDB | 1axc (RCSB PDB PDBe PDBj) |
| RefSeq | NM_002592 |
| UniProt | P12004 |
| Other data | |
| EC number | 2.7.7.7 |
| Locus | Chr. 20 pter-p12 |
كتيلة بيتا
كتيلة بيتا هي كتيلة دنا محددة ووحيدات دنا بوليميراز 3 هولوإنزيم الموجودة في بدائيات الدنا. تتجمع وحيدتا بيتا حول الدنا بواسطة وحيدة جاما و تحلل أدينوسين ثلاثي الفوسفات، ويدعى هذا التجمع بمعقّد ما قبل التضاعف. بعد التجمع حول الدنا، فإن وحيدات الانجذاب من نوع بيتا لوحيدات جاما تستبدل بانجذاب لوحيدات ألفا وإبسيلون والتي تصنع سوية تركيبا كاملا للإنزيم (بالإنجليزية: Holoenzyme).[3][4][5] إن بوليمزيرات الدنا الثلاثية هي الإنزيم الرئيسي المعقد الذي يشارك في تضاعف دنا بدائيات النوى.
مراجع
- ↑ PDB 1MMI; Oakley AJ, Prosselkov P, Wijffels G, Beck JL, Wilce MC, Dixon NE (2003). "Flexibility revealed by the 1.85 Å crystal structure of the beta sliding-clamp subunit of Escherichia coli DNA polymerase III". Acta Crystallogr. D Biol. Crystallogr. 59 (Pt 7): 1192–9. PMID 12832762. doi:10.1107/S0907444903009958. Unknown parameter
|month=ignored (|date=suggested) (help) - ↑ Bruck I, O'Donnell M (2001). "The ring-type polymerase sliding clamp family". Genome Biol. 2 (1): REVIEWS3001. PMC 150441
 . PMID 11178284.
. PMID 11178284.
- ↑ Lewin, Benjamin (1997). Genes VI. Oxford [Oxfordshire]: Oxford University Press. pp. 484–7. ISBN 0-19-857779-6.
- ↑ Lehninger, Albert L (1975). Biochemistry: The Molecular Basis of Cell Structure and Function. New York: Worth Publishers. p. 894. ISBN 0-87901-047-9.
- ↑ Stukenberg PT, Studwell-Vaughan PS, O'Donnell M (1991). "Mechanism of the sliding beta-clamp of DNA polymerase III holoenzyme". J. Biol. Chem. 266 (17): 11328–34. PMID 2040637. Unknown parameter
|month=ignored (|date=suggested) (help)
اقرأ أيضاً
قراءات إضافية
- Watson JD, Baker TA, Bell SP, Gann A, Levine M, Losick R (2004). Molecular Biology of the Gene. San Francisco: Pearson/Benjamin Cummings. ISBN 0-8053-4635-X.
وصلات خارجية
- SCOP DNA clamp fold
- CATH box architecture
- clamp protein DnaN, E coli at the US National Library of Medicine Medical Subject Headings (MeSH)