كبريتات الصوديوم
| د. سلام المجذوب |
| المساهمة الرئيسية في هذا المقال |
| Sodium sulfate | |
|---|---|

|
|
Other names Thenardite (mineral) | |
| المعرفات | |
| رقم CAS | |
| بوبكيم (PubChem) | |
| ChemSpider | 22844 |
| UNII | 36KCS0R750 |
| ChEBI | CHEBI:32149 |
| ChEMBL | CHEMBL233406 |
| RTECS number | WE1650000 |
| كود ATC | A06,A12CA02 |
| Jmol-3D images | Image 1 |
| |
| |
| الخصائص | |
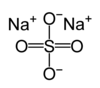
| صيغة جزيئية | Na2SO4 |
| الكتلة المولية | 142.04 g/mol (anhydrous) 322.20 g/mol (decahydrate) |
| المظهر | white crystalline solid hygroscopic |
| Odor | odorless |
| الكثافة | 2.664 g/cm3 (anhydrous) 1.464 g/cm3 (decahydrate) |
| نقطة الانصهار |
884 °C (anhydrous) |
| نقطة الغليان |
1429 °C (anhydrous) |
| قابلية الذوبان في الماء | anhydrous: 4.76 g/100 mL (0 °C) 42.7 g/100 mL (100 °C) heptahydrate: 19.5 g/100 mL (0 °C) 44 g/100 mL (20 °C) |
| قابلية الذوبان | insoluble in ethanol soluble in glycerol and hydrogen iodide |
| Refractive index (nD) | 1.468 (anhydrous) 1.394 (decahydrate) |
| Structure | |
| Crystal structure | orthorhombic or hexagonal (anhydrous) monoclinic (decahydrate) |
| المخاطر | |
| MSDS | ICSC 0952 |
| EU Index | Not listed |
| Main hazards | Irritant |
| NFPA 704 | |
| Flash point | Non-flammable |
| مركبات قريبة | |
| Other anions | Sodium selenate Sodium tellurate |
| Other cations | Lithium sulfate Potassium sulfate Rubidium sulfate Caesium sulfate |
| Related compounds | Sodium bisulfate Sodium sulfite Sodium persulfate |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
كبريتات الصوديوم (Sodium sulfate) وهو مركب كيميائي له الصيغة Na2SO4، وهو الملح الصوديومي لحمض الكبريت. يمكن أن يتواجد بشكل لامائي ويدعى الشكل الخام منه أثناء إنتاجه بـكعكة الملح، أو متسانداً مع عشرة جزيئات ماء Na2SO4.10H2O ويدعى في هذه الحالة ملح غلاوبر. يتم الحصول على هذا الملح تقريباً بشكل متساوي إما من مصادر طبيعية أو من مصادر صناعية من المنتجات الثانوية لصناعة الرايون، الليثيوم، حمض كلور الماء ومركبات الكروم.
التحضير
من أهم المصادر الصناعية لكبريتات الصوديوم هي النواتج الثانوية لصناعة مركبات الكروم. تتم مفاعلة حمض الكبريت مع كلوريد الصوديوم حسب طريقة مانهايم، حيث يتشكل في البداية بيكبريتات الصوديوم ومن ثم الملح المطلوب وذلك حسب المعادلات التالية:
NaCl + H2SO4 → NaHSO4 + HCl
NaCl + NaHSO4 → Na2SO4 + HCl
العملية تجرى بشكل متقطع (Batch process).
توجد طريقة أخرى لتحضير هذا الملح بدرجة أعلى وذلك حسب طريقة هاريغريفز :
4NaCl + 2SO2 + 2H2O + O2 → 2Na2SO4 + 4HCl
تحضير ملح غلاوبر
يحضر ملح غلاوبر Na2SO4.10H2O وذلك بحل كعكة الملح بالمحلول الأم (mother liquor) وبإزالة الشوائب والتصفية ثم إعادة البلورة. يعالج المحلول بالكلس وأملاحه لتعديل الوسط، وبعد إزالة الشوائب الراسبة من أملاح الحديد، المغنيزيوم، والكالسيوم يمرر المحلول إلى مبلورات حيث يتم الحصول على البلورات بعد إجراء عملية التثفيل.
الاستخدامات
- الاستهلاك الأعظمي من ملح كبريتات الصوديوم يكون في صناعة عجينة الورق (kraft pulp).
- يستخدم في صناعة المنظفات المنزلية.
- يستخدم في صناعة الزجاج وذلك لإزالة فقاعات الهواء الصغيرة من الزجاج المصهور.
- يستخدم في الصناعات النسيجية حيث يضاف أثناء الصباغة لتقليل الشحن السالبة على الألياف مما يسهل من انتشار الصباغ بشكل متساوي.
