تقنية الورم الهجين
| د. زيد الهبري |
| المساهمة الرئيسية في هذا المقال |
تقنية الورم الهجين
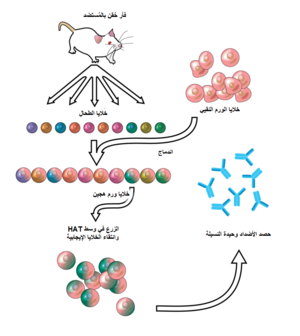
تقنية الورم الهجين hybridoma هي طريقة لإنتاج أعداد كبيرة من الأضداد المُتطابقة (تسمى أيضًا بالأضداد وحيدة النسيلة monoclonal antibodies). تبدأ هذه العملية بحقن فأر بمُستضد antigen يُحرّض لاستجابة مناعية، ويُحصد بعدها من الفأر نمط من خلايا الدم البيض وهي الخلايا البائية B cells التي تنتج أضدادًا ترتبط بالمُستضد، وبعدها تُدمج تلك الخلايا البائية المعزولة مع خلايا بائية سرطانية خالدة، وهي خلايا الورم النقيي myeloma، لكي تنتج خطا خلويًا هجينًا يُسمى الوَرم الهجين. يُنتقى خط الخلوي للورم النقيي المُستعمل في هذه العملية لقدرته على النمو في مزرعة نسيجية ولغياب إنتاجه للأضداد، وبعكس الأضداد مُتعددة النسائل polyclonal antibodies، تبدي الأضداد وحيدة النسيلة التي ينتجها الورم الهجين جميعًا انتقائية مفردة للمستضد.
ابتكر سيزر ميلستاين وجورج جي. اف. كولر عملية إنتاج الأضداد وحيدة النسيلة عام 1975، وتشاركا بجائزة نوبل عام 1984 للطب والفيزيولوجيا مع نيل زكاي يرني، الذي قدّم اسهامات أخرى في علم المناعة، وابتكر ليونارد هيرزنبيرغ مُصطلح الورم الهجين خلال بعثته لمُختبر سيزر ميلستاين في الفترة 1976/1977.
الطريقة
تُعرّض أولًا حيوانات الاختبار (الثديّات مثل الفئران) للمُستضد التي يُراد الحصول على ضد تجاهها، ويُجرى هذا غالبًا بسلسلة من الحقن الحاوية على المُستضد على مدى عدّة أسابيع، ويتبع تلك الحقن بالعادة استعمال التثقيب الكهربائي electroporation في الكائن الحي in vivo، وهذا يُعزز بقوة من الاستجابة المناعية. بعد عزل الخلايا الطحالية من طحال الحيوان الثديي، تُدمج الخلايا البائية مع خلايا الورم النقيي الخالدة، ويُمكن إجراء هذا باستعمال الدمج الكهربي electrofusion. يؤدي الدمج الكهربي لتراصف واندماج الخلايا البائية مع خلايا الورم النقيي عند تطبيق حقل كهربائي، وتنتقى خلايا الورم النقيي مُسبقًا بحيث لا تفرز أيّة أضداد بذاتها وأن تفتقر لجين هيبوكزانتين – غوانين فوسفوريبوزيل – ترانسفيراز (HGPRT) مما يجعلها حساسة للوسط HAT.
تُحضن الخلايا المُندمجة في الوسط HAT (وسط هيبوكزانتين – أمينوبتيرين – ثيميدين) لحوالي 10 إلى 14 يومًا. يحجب الأمينوتيرين السبيل الذي يسمح لاصطناع النوكليوتيدات، وبالتالي تموت خلايا الورم النقيي غير المُندمجة لأنّها لا تستطيع إنتاج النوكليوتيدات عبر سبل التجديد de novo أو الإنقاذ وذلك لافتقارها لجين HGPRT. إزالة خلايا الورم النقيي غير المندمجة ضروري لامتلاكها القدرة على أن تنمو وتطغى على الخلايا الأخرى، خاصة خلايا الورم الهجين المُتجدّدة أسبوعيًا. كما تموت الخلايا البائية غير المُندمجة بسبب قصر مدة حياتها. بذلك تنجو فقط الخلايا الهجينة من الخلايا البائية – الورم النقيي، لأنّ الجين HGPRT الفعّال يأتي من الخلايا البائية. تنتج تلك الخلايا الأضداد (خاصية من الخلايا البائية) وهي خالدة (خاصية من خلايا الورم النقيي). يُمدد بعدها وسط الحضن في صفيحة متعددة الآبار لدرجة تسمح بوجود خلية واحدة فقط في كل بئر. بما أنّ الأضداد في البئر ناتجة عن ذات الخلية البائية، فستكون موجّهة نحو ذات الحاتمة epitope، وتسمى بذلك بوحيدة النسيلة.
المرحلة التالية عبارة عن عملية تحرّي أولية سريعة، ويُحدّد بها وتنتقى فقط خلايا الورم الهجين التي تنتج الأضداد ذات الانتقائية المُناسبة، وتقنية التحرّي المُستعملة الأولى هي تقنية ELISA. تحضن بعدها المادة الطافية من مزرعة الورم الهجين، مع مُقترن conjugate موسوم بإنزيم ثانوي وركيزة مولّدة للّون، ويُشير تكوين منتج ملوّن إلى وجود ورم هجين إيجابي. بدلا عن ذلك يُمكن استعمال التحرّي المناعي الخلوي الكيميائي.
يُمكن تنسيل الخلية البائية المُنتجة للأضداد المرغوبة بغاية إنتاج نسائل بنت مُطابقة. يُستعمل وسط مُتمّم يحوي الإنترلوكين 6 بصورة أساسية في هذه الخطوة، وبعد الحصول على مستعمرة للورم الهجين تنقل لوسط زرعي مثل RPMI-1640 (مع صادات حيوية والمصل البقري الجنيني) لتنمو بصورة مستمرة وتنتج الأضداد.
تستعمل الصفائح متعددة الآبار مبدئيًا لتنمية خلايا الورم الهجين، وتبدّل بعد الانتقاء بدوارق زرع نسيجي أكبر، ويُحافظ هذا على سلامة خلايا الورم الهجين ويوفر عددًا كافيًا من الخلايا للحفظ بالبرودة وقدرًا كافيًا من السائل الطافي للاختبارات التالية. يُمكن للسائل الطافي الزرعي أن يثمر بـ1 إلى 60 مكغ/مل من الأضداد وحيدة النسيلة، ويُحفظ بدرجة حرارة -20 ◦C أو أقل إلى حين الحاجة إليه.
يُمكن إجراء مزيد من التحاليل لخلايا ورم هجين منتجة لأضداد وحيدة نسيلة محتملة باستعمال السائل الطافي للمزرعة أو بمحضّر غلوبولين مناعي مُنقى وذلك بدراسة التفاعلية، والانتقائية والتفاعل المُتصالب.
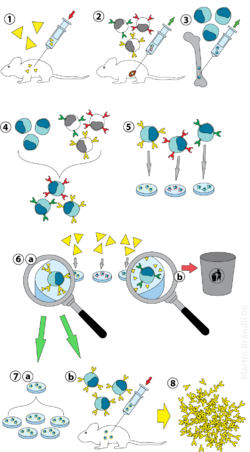
(1) تمنيع الفأر
(2) عزل الخلايا البائية من الطحال
(3) زرع خلايا الورم النقيي
(4) دمج خلايا الورم النقيي مع الخلايا البائية
(5) فصل الخطوط الخلوية
(6) التحرّي عن الخطوط الخلوية المُناسبة
(7) المُضاعفة في الزجاج (a) أو في الكائن الحي (b)
(8) الحصد
التطبيقات
تطبيقات الأضداد وحيدة النسيلة شاسعة وتتضمّن الوقاية من الأمراض وتشخيصها وعلاجها، فمثلًا يُمكن للأضداد وحيدة النسيلة تمييز مجموعة فرعية من الخلايا البائية والخلايا التائية، مما يُفيد في تحديد أنماط مختلفة من ابيضادات الدم. فضلًا على هذا استعملت أضداد وحيدة نسيلة نوعية لتحديد واسمات السطح الخلوي على خلايا الدم البيضاء وأنماط خلوية أخرى، وأدى هذا لسلسلة من عنقود التمايز للواسمات، ويُشار لها عادة بالواسمات CD وتحدد هوية مئات من مكوّنات سطح الخلية المختلفة، وتحدّد كلا منها بارتباط ضد وحيد نسيلة خاص بها. هذه الأضداد مفيدة للغاية في فرز الخلايا المُنشّطة بالتألّيق، أي العزل النوعي لنمط خاص من الخلايا.
في علم الأنسجة المرضي التشخيصي
يُمكن بمُساعدة الأضداد وحيدة النسيلة تصنيف النسج والأعضاء وفقًا لتعبيرها لواسمات مُعرّفة مُحدّدة، والتي تعكس النشوء النسيجي أو الخلوي. يُعدّ كل من مُستضد البروستات النوعي، والفوسفاتاز القلوية المشيمية، ومُوجّهة الغُدد التناسلية المشيمائية البشرية، وألفا فيتوبورتين وغيرها من المكوّنات مُستضدّات مرتبطة بالعضو ويُساعد إنتاج أضداد موجّهة لهذه المُستضدات في تحديد طبيعة الورم الأولي.
تفيد الأضداد وحيدة النسيلة خاصة في تمييز الآفات المُتشابهة مورفولوجيًا، مثل ورم المُتوسّطة mesothelioma الجنبية pleural والصفاقية peritoneal، والسرطانة الغدية adenocarcinoma، وفي تحديد أيّ نسيج أو عضو كان مصدرًا للنقائل غير المُتمايزة. تُساعد أيضًا أضداد وحيدة نسيلة مُعيّنة في كشف النقائل الخفية (سرطان من أصل أولي غير معلوم) بالتحليل المناعي الخلوي لنقي العظم، ورُشافات نسيجية أخرى، وكذلك العقد اللمفية ونسج أخرى وقد يكون ذو حساسية أعلى من التلطيخ النسيجي المرضي المُعتاد.