بنزن
يعتبر البنزن من أبسط المركبات العطرية، فهو المركب العطري الأول. وهو عبارة عن حلقة سداسية تحوي ثلاث روابط مضاعفة متسلسلة (متناوبة) وكما رأينا أن البنية للحلقة السداسية بدون هذه الروابط المضاعفة هي حلقي الهكسان شكله شكل كرسي أما البنزن فهو ذو بنية مستوية بسبب روابطه المضاعفة المتناوبة ,وهذا التناوب يسبب عنده نوع من الثبات حيث أن الألكترونات الستة تدور حول ذرات الكربون الستة (الطنين) لذلك البنزن يعطي تفاعلات التبادل الإلكتروفيلي أما تفاعلات الضم لا يعطيها إلا تحت شروط قاسية جداً فهو يفضل المحافظة على روابطه و تسلسل إلكتروناته بالتالي على ثباته أما المركبات (الألكنات و الألكينات ) تعطي تفاعلات ضم أكثر من تبادل.
الصيغة العامة للبنزن C6H6 يحتوي على 3 روابط مضاعفة شأنه شأن الألكينات Alkenes، لكن الألكينات تعطي تفاعلات الضم بسهولة وتفاعلات التبادل بصعوبة.
أما البنزن فإنه يعطي تفاعلات الضم بصعوبة كبيرة بينما يعطي تفاعلات التبادل بسهولة أكبر (وذلك لأنه في حال القيام بتفاعلات الضم سيحدث فصم للرابطة باي و هذا يحتاج إلى ظروف قاسية من حرارة وضغط وذلك بسبب قوة هذه الرابطة بوجود التغطية الالكترونية، أما في حال الاستبدال فلا يحدث فصم لهذه الرابطة، لذلك يميل البنزن إلى الاستبدال)
صفات بنية البنزن Structure of Benzene
- الروابط كلها متساوية طولها 139pm وهو طول وسط بين طول الرابطة المضاعفة والرابطة المفردة...
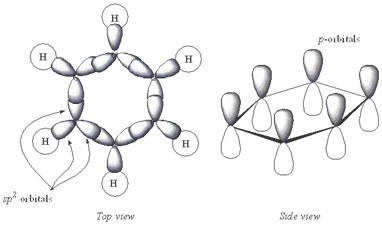
- البنية مستوية planar ومسدسة hexagonal.
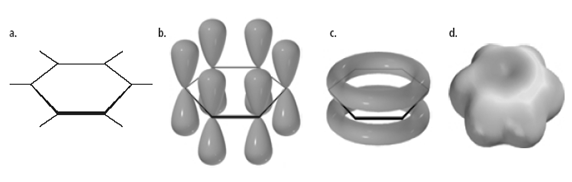
- الكثافة الإلكترونية موزعة بشكل متجانس (الكثافة الإلكترونية واحدة على الذرات الستة) أي أن الإلكترونات الستة غير متوضعة delocalized
- الزوايا بين جميع روابط الكربون C-C-C 120درجة ← كل ذرة كربون SP2 وكل ذرة تملك مدار P عمودي على المستوي وكل P فيه إلكترون واحد تكوّن غمامة إلكترونية بين الـستة P أعلى وأسفل المستوي.
فالنواة البنزينية نواة غنية بالإلكترونات، والروابط π غير متوضعة (عدم توضع إلكتروني) وهو يعطي الثبات أو الطنين.