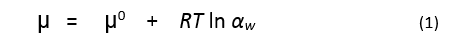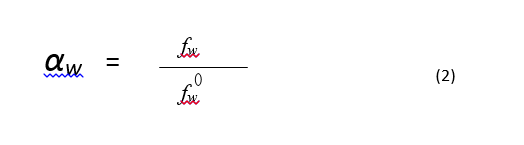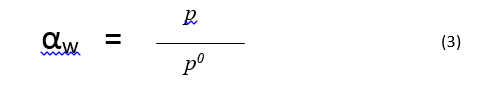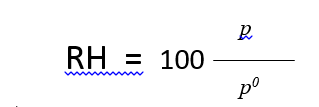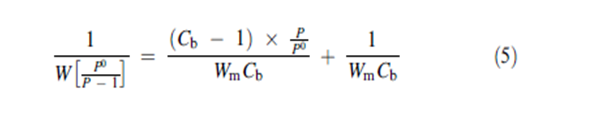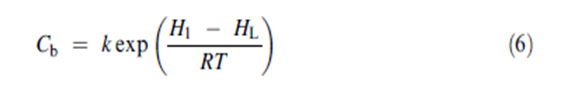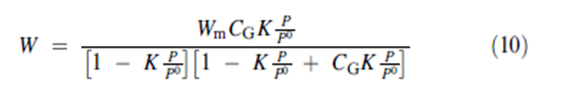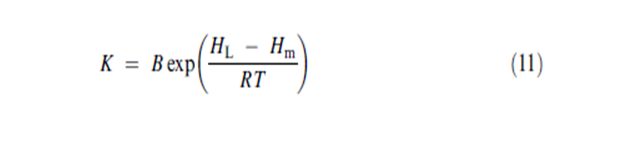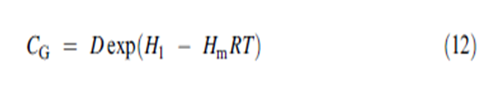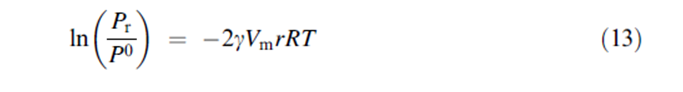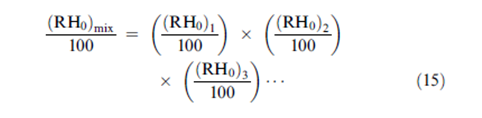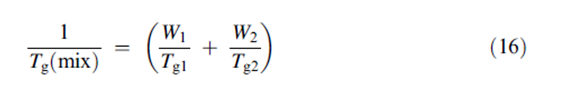الفرق بين المراجعتين لصفحة: «امتزاز الماء للأدوية والأشكال الصيدلانية»
كنان الطرح (نقاش | مساهمات) (أنشأ الصفحة ب'امتزاز الماء للأدوية و الأشكال الصيدلانية Water Sorption of Drugs and Dosage Forms مقدمة INTRODUCTION : تعتمد الخوا...') |
كنان الطرح (نقاش | مساهمات) |
||
| (6 مراجعات متوسطة بواسطة نفس المستخدم غير معروضة) | |||
| سطر 22: | سطر 22: | ||
[[ملف:1.PNG]] | [[ملف:1.PNG]] | ||
حيث أن µ هي الكمون الكيمائي للماء في الجملة عند التوازن و µ˚ هي الكمون الكيمائي المعياري للماء عند درجة حرارة مرجعية معينة وضغط معين و R هي ثابت الغازات و T هي درجة الحرارة المطلقة. عرَف لويس الفعالية النسبية لأي مادة نقية أو مركب ( كالماء) كنسبة الافتلات | |||
[[ملف:2.PNG]] | |||
حيث هي افتلات الماء في الجملة عند التوازن وهي افتلات الماء النقي عند درجة حرارة معيارية وضغط معياري، من أجل غايات عملية فإنه يمكن تقريب انفلات (قابليته للارتشاح) بخار الماء بواسطة ضغط بخار الماء في الجملة. هذا الافتراض يكون صحيحا طالما أن بخار الماء يسلك سلوك الغاز المثالي. من أجل مجال ضغط بخار الماء الذي له علاقة بالجملة الصيدلانية عند درجة حرارة أقل من 50 درجة مئوية يكون التقريب ممتاز ( أصغر من 0.2 % كخطأ نسبي) لذا يستعمل الضغط النسبي لبخار الماء عادة كتقدير لفعالية الماء النسبية في الجملة. | |||
[[ملف:3.PNG]] | |||
حيث أن هو ضغط بخار الماء في الجملة وهو ضغط بخار الماء النقي عند درجة الحرارة المدروسة. تعرف الرطوبة النسبية على أنها ضغط نسبي معبر عنه كنسبة مئوية: | |||
[[ملف:4.PNG]] | |||
يُكتسب قسم الامتصاص لخط تساوي درجة الحرارة تجريبيا من خلال قياس الكمية المتوازنة من الماء الممتص على الجسم الصلب عند الضغط النسبي المعلوم، ابتداء بكتلة معلومة لجسم صلب جاف حتما وبعد ذلك تزايد تدريجي للضغط النسبي في الجملة. تجفيف عينة الجسم الصلب بتعريضها للحرارة ربما باستخدام الخلاء لتسهيل إزالة بخار الماء الممتص غالبا ما يكون ضروريا. ولكن يجب أن نكون مدركين لتأثير هذه الشروط على الثباتية الفيزيائية والكيميائية للجسم الصلب. يكتسب قسم الامتزاز لخط تساوي درجة حرارة للضغط النسبي من خلال تناقص تدريجي للضغط النسبي في الجملة من ضغط نسبي لوحدة تقريبية و أيضا مراقبة الكمية المتوازنة من الرطوبة الممتصة عند كل ضغط نسبي. | |||
تذكر أن خط تساوي درجة الحرارة للرطوبة الممتصة هو قياس متوازن لتفاعل الماء مع الجسم الصلب. إن المعلومات المتعلقة بحركية امتصاص الرطوبة نظريا ليست مستمدة بشكل واضح من التجربة. هذا التفريق هام جدا وسيتم الخوض فيه بعمق أكثر لاحقا. | |||
يمكن أن يزود تولد خط تساوي درجة الحرارة لامتزاز أو امتصاص الماء لجسم صلب منفرد بنظرة هامة إلى طبيعة التفاعل بين الماء والجسم الصلب. وأيضا مميزات السطح لجسم صلب. هذه المعلومات مستمدة بسهولة من كمية الرطوبة الممتصة عند رطوبة نسبية أدنى بالمقارنة مع مساحة السطح النوعية للعينة. وتستمد المعلومات أيضا من الشكل العام لخط تساوي درجة الحرارة ومن ما إذا كان امتصاص الماء عملية عكوسة تماما أو لا ( إذا كان التلاكؤ ملاحظا بين الامتزاز والامتصاص ) وتستمد أيضا من شكل عقدة التلاكؤ إذا كانت موجودة . | |||
ويمكن للمرء من خلال المعلومات المذكورة سابقا أن يستمد دلالة فيما يتعلق بآلية امتصاص الرطوبة للمواد ذات الأهمية على سبيل المثال المادة التي تبدي امتصاصا عند رطوبة نسبية أدنى بكميات أكبر بكثير من التي يمكن توقعها اعتمادا على مساحة السطح النوعية للعينة وتبدي تلاكؤاَ خلال المجال الكامل لدرجات الرطوبة النسبية هي غالبا ما تمتص الماء ضمن بنيتها الداخلية. ومن جهة أخرى فإن إظهار المادة لعقدة تلاكؤ مغلقة خلال مجال رطوبة نسبية أعلى بينما تبدي امتصاصا للرطوبة خلال مجال رطوبة نسبية أدنى مشابه لما يمكن توقعه اعتمادا على مساحة سطحها النوعية هي على الأرجح أن تكون ذات طبيعة مسامية تماما وغالبا ما تمتص الماء بواسطة تكاثف شعري خلال مجال رطوبة نسيبة أعلى. | |||
==نماذج لوصف امتزاز البخار MODELS DESCRIBING VAPOR ADSORPTION== | |||
===Brunauer, Emmett, and Teller Equation === | |||
تم وضع النموذج الذي يشار إليه في الأدب بشكل شائع والذي يصف امتزاز البخار على السطوح الصلبة في الشهر الرابع من عام ألف وتسعمئة وثمان وثلاثون على يد العلماء , and Teller , Emmett , Brunauer | |||
تم اشتقاق النموذج الذي يدعى BET model بشكل أساسي باستخدام براهين حركية بأسلوب مشابه كثيرا لتلك البراهين المستخدمة من قبل Langmuir ومنذ ذلك الوقت تم أيضا اشتقاق النموذج BET باستخدام تقنيات إحصائية. يفترض النموذج BET أن جزيئات البخار تسلك سلوك غاز مثالي موجود في حالة توازن مع مادة صلبة مكونة من مواقع متشابهة ومتجانسة وممتزة. يفترض أن يكون الجزيء الأول الممتز على موقع امتزاز المادة الصلبة مرتبطا بينما يفترض أن تمتلك الجزيئات الممتزة خلف الطبقة الأولى خصائص معظم السائل. من ناحية أخرى يفترض أن يحدث الامتزاز كي لا تتفاعل الجزيئات الممتزة لاحقا. | |||
الشكل الخطي لمعادلة BET هي: | |||
[[ملف:5.PNG]] | |||
حيث أن W : هي كتلة البخار الممتز في كل غرام من المادة الصلبة عند ضعط نسبي محدد. | |||
p/p0 ; Wm : هي الكمية النظرية للبخار الممتز عند امتلاك كل موقع امتزاز لجزيء بخار واحد ممتز عليه و | |||
[[ملف:6.PNG]] | |||
حيث H1 هي حرارة امتزاز أول جزيء بخار ممتز على الموقع HL هي حرارة التكثيف لمعظم الحجم المكثف | |||
R هي ثابت الغازات العام و T هي درجة الحرارة المطلقة و K هو ثابت يفترض عادة أن يكون مقاربا للواحد. يمكن الحصول بسهولة على ثابتي BET من شكل النموذج الخطي لمعادلة BET المعطاة في المعادلة رقم 5. يعطينا تعيين الكمية 1/[W(P0/P _ 1)] مقابل P/P0 ميلا مساويا ل (Cb _ 1)/WmCb و تقاطعه مع محور العينات 1/WmCb | |||
تعطي المعالجة الجبرية | |||
[[ملف:7.PNG]] | |||
بشكل عام تناسب معادلة النموذج BET بيانات الامتزاز بشكل جيد جدا خلال مجال ضغط نسبي يتراوح بين 0.05 و 0.35 ولكن يتوقع أن يتم امتزاز أكثر عند ضغط نسبي أعلى من الملاحظ في التجربة. وهذا متناسق مع افتراض تم وضعه من اشتقاق النموذج BET أن عددا لانهائيا من الطبقات تمتز عند ضغط نسبي مقارب للواحد. تتم تطبيقات المعادلة على نتائج امتزاز غاز لاقطبي بشكل متكرر للحصول على تقدير لمساحة سطح محددة للعينات الصلبة. | |||
بافتراض مساحة مقطع عرضي لجزيئات ممتزة نستطيع استخدام BET لحساب مساحة السطح المحددة من خلال العلاقة التالية: | |||
[[ملف:9.PNG]] | |||
حيث أن S مساحة السطح المحددة بالمتر المربع على غرام . Wmهي كتلة التكثيف الممتزة على تغطية مكونة من طبقة واحدة | |||
X هي مساحة مقطع عرضي لجزيئات التكثيف الممتزة (يفترض أن تكون 19.5 أنغستروم مربع لغاز الكريبتون و 16.2 أنغستروم مربع لغاز النتروجين و 12.5 للماء) Nav هي عدد افوغادرو و∑ هي الكتلة الجزيئية للمادة المتكثفة وM هي كتلة العينة. بشكل واضح فإن حساب مساحات السطوح من بيانات امتصاص الرطوبة التي لا تؤدي إلى تغطية مكونة من طبقة واحدة عند Wm( إما تغطية غير كاملة ( انظر إلى الأسفل قسم * امتصاص الماء على المواد اللامائية *) أو امتصاص داخل المادة الصلبة ( انظر إلى قسم * تفسير مساحات السطوح المحددة المحسوبة من دراسات الماء الممتص )) سوف ينتج عنها قيم غير صحيحة ليس لها أي معنى فيزيائي . ولذلك فإن مقارنة مساحة السطح المقاسة بامتزاز غاز لاقطبي مع تلك المحسوبة من خط تساوي امتصاص الرطوبة يمكن أن تعطينا نظرة على التفاعلات الأساسية بين الماء والمادة الصلبة. وسيتم اكتشاف هذا بعمق لاحقا. | |||
===Guggenheim and deBoer Equation === | |||
تم القيام بالعديد من المحاولات لتعديل نظرية الامتزاز BET منذ اشتقاقها الأصلي. ولكن بساطة هذه النظرية و قدرتها على احتواء بيانات الامتصاص بشكل جيد عند ضغط نسبي منخفض جعلت منها الخيار النموذجي لتقدير مساحات السطوح لامتزاز الغاز اللاقطبي. ظهر العديد من تعديلات النموذج BET كإضافة عامل متغير مناسب على الأقل للمعادلة لتحليل البيانات خلال كامل مجال الضغط النسبي. هذا يجعل تجهيزات الكومبيوتر ضروية بسبب توفر عاملين متغيرين قابلين للقياس فقط هماW و p/p0. من وجهة نظرنموذجية فإن عوامل التغيير الإضافية لمضمون فيزيائي غير معروف أو غير محدد والتي ظهرت من مثل هكذا أساليب غالبا ما تكون مانعة لاستخدام نماذج عوامل تغيير متعددة بسبب الصعوبات المتكررة في تفسير النتائج. ضمن هذا الاعتبار فإن تعديلا واحدا فقط للنموذج BET والذي ظهر أنه تجاوز مجال الضغط النسبي الذي يحوي بيانات امتزاز البخار سيتم اعتباره هنا. تم اعتبار هذا الامتداد للنموذج BET المشتق بشكل مستقل من قبل العالمين Guggenheim و deBoer من أجل حالة وسطية للبخار بين الجزيء الأول المرتبط بقوة الممتز على موقع الامتزاز و بين جزيئات التكثيف الممتزة ضمن ضغط نسبي عالي جدا. يمكن اعتبار أن الجزيئات الممتزة في المجال الوسطي تتفاعل مع المادة الصلبة ولكن هذا التفاعل يُفترض أن يكون أقل من تفاعل الجزيء الأول الممتص على موقع الامتزاز. وبشكل واضح فإن إضافة ( حالة ثالثة) للتفاعل هي تقريبية. في جميع الاحتمالات هناك تتابع لحالات التفاعل ولكن من وجهة نظر حسابية فإن تمدد ثلاث حالات أو أكثر غير مُلاحظ. تعطى معادلة تفاعلات الحالات الثلاثة من خلال العلاقة: | |||
[[ملف:10.PNG]] | |||
حيث P و P0 وHL وW و Wm هي مطابقة لعوامل التغيير المتسخدمة في معادلة النموذج BET | |||
و | |||
[[ملف:11.PNG]] | |||
حيث B هي ثابت و T هي حرارة البخار الممتز في الطبقة الوسطى. يُعرَف الثابت CG ك : | |||
[[ملف:12.PNG]] | |||
حيث ان D ثابت و H1 هي حرارة الامتزاز لأول جزيء ممتز على الموقع وHm هي حرارة الامتزاز للجزيء المرتبط وسطيا. | |||
==امتزاز بخار الماء بواسطة المواد الصلبة اللابلورية Water Vapor Absorption by Amorphous Solids== | |||
قورنت عملية تفاعل بخار الماء مع المواد الصلبة اللابلورية مع عملية إنتاج محلول صلب الذي فيه ينحل الماء في القالب الصلب. ومع امتصاص كمية أكبر من الماء فإن الخواص الأساسية للقالب الصلب (على سبيل المثال اللزوجة) يمكن ان يطرأ عليها تغير معتبر والذي يمكن أن يسبب تغيرات مرئية في الخواص الفيزيائية (على سبيل المثال الانهيار وإعادة البلورة ). وسيتم مناقشة ذلك بتفصيل أكثر لاحقا. | |||
على الرغم من أن بخار الماء يمتص ضمن المواد الصلبة اللابلورية وليس يمتز على السطح بوضوح فإنه وجد أن خط تساوي الامتصاص يمكن أن توافقه معادلة النموذج BET حتى p/p0 يقارب ال 0.40 مع امتزاز البخار وخلال المجال الكامل ل p/p0 باستخدام امتداده. ولأن ذلك تم الإعلان عنه أولا من قبل العالم Anderson لتكون حالة امتصاص الماء ( المعادلة 10 )عند تطبيقها على امتصاص بخار الماء غالبا ما تدعى معادلة GAB للعلماء Guggenheim و Anderson و deBoer .من أجل المنهج النظري لاشتقاق المعادلة الأصلية الذي لا يترجم بشكل مباشر إلى عملية الامتصاص التي تتضمن انحلالية الماء في الأجسام الصلبة اللابلورية فإن مدلول ملائمته للمعادلة GAB محدود قليلا. غير أن المعادلة GAB معادلة مفيدة لأنها تسمح للشخص أن يصف كامل خط التساوي وأن يسحب بعض عوامل التغير المفيدة( سيتم شرحها لاحقا ). | |||
بما أن بخار الماء ينحل ضمن المادة الصلبة خلال الامتصاص فإنه تم اشتقاق نماذج عديدة اعتمادا على نظرية المحل تفرض أن السوربات تدخل ضمن المادة الصلبة كمحلول صلب وتم استخدام هذه النماذج لوصف امتصاص الماء على البوليميرات. | |||
مثل Flory Huggins,[20] Hallwood-Horrobin[21] )- ) فقد طورا مؤخرا نموذج معتمد على المحلول يفسر التأثير اللين للماء على البولمير الذي ظهر انه يصف كامل خط تساوي امتصاص الرطوبة للبوليمير. بينما اعتمدت نظريات الامتصاص و العديد من التعديلات على نموذج الامتزاز BET على أساسات فيزيائية كيميائية ذات معنى فإنه مازال يتطلب عملا إضافيا من أجل تفسير التقنية الجزيئية امتصاص ضمني للرطوبة في النظام البوليمري. من هذا المنظور فان نماذج أخرى معتمدة على مفاهيم مختلفة نظريا كليا لم يتم اعتبارها في هذه المقالة. من أجل مراجع أخرى فإنه يتم توجيه القارئ إلى مراجع مطبوعة متعددة و ممتازة للعديد من نظريات الامتصاص التي تم اقتراحها. | |||
==التكثيف الشعري : Capillary Condensation== | |||
يختلف امتصاص البخار على المادة الصلبة المسامية عن امتصاصه على سطوح المواد المسطحة في أن البخار ( في هذه الحالة , الماء ) سوف يتكثف إلى سائل ذو بنية مسامية عند ضغط البخار pr أدنى من ضغط البخار p0 الذي يحدث عندما يكون التكيثف عند سطوح مسطحة. يعود هذا بشكل عام إلى قوى التجاذب المتزايدة بين الجزيئات الممتزة و التي تظهر كأنها سطوح منحنية بقوة كمسام أو أنبوب شعري. يشار إلى هذه الظاهرة بالتكثيف الشعري وتوصف بمعادلة Kelvin | |||
[[ملف:13.PNG]] | |||
حيث أن هي التوتر السطحي للطبقة الرقيقة الممتزة ( يفترض أنه مساوي للتوتر السطحي على معظم السائل) و Vm هو الحجم المولي للسائل و r هي نصف قطر المسام و R هي ثابت الغازات العام و T هي درجة الحرارة. أظهرت معادلة Kelvin أنها قابلة للتطبيق على المسام ذات نصف قطر صغير ك 5 نانومتر لامتصاص الماء على الميكا. كما ذكر في قسم ( خط تساوي امتصاص الماء) فإن التكثيف الشعري سوف يظهر على شكل حلقة تلاكؤ مغلقة في خط تساوي الامتصاص والامتزاز للمادة المسامية. يظهر حساب pr/p0 أن التكثيف متوقع عند ضغط نسبي مساوي ل 0.998, 0.989, 0.898) 0.340 ,) وذلك لسم نصف قطره مساوي ل (1000 و 100 و 10 و1) نانومتر على التوالي وذلك بافتراض قيمة توتر سطحي للماء مساوي ل 72.8 ergs/cm2وكثافة مساوية ل 0.998 g/cm3 عند درجة حرارة 293K ( قد أظهر هذا الافتراض من أجل استعمالات الحساب أن كثافة الماء هي أخفض في السم من معظم الحجم). في هذا الصدد يظهر بشكل واضح أن الحاجة إلى التكثيف الشعري تؤخذ بعين الاعتبار فقط من أجل أبعاد صغيرة جدا للسم. بتعابير عملية فإنه يجب أن يهتم الإنسان بفهم تقنيات الماء من أجل مساحيق صيدلانية مسامية دقيقة والتي تبدي مساحات سطح نوعية كبيرة نسبيا ( مثال < 100m2/g) التي حددت من خلال دراسات على امتزاز غاز غير قطبي . | |||
==المنهجيات : METHODOLOGY== | |||
===التحكم بالرطوبة النسبية Control of Relative Humidity=== | |||
إن الحفاظ على بيئات ذات رطوبة نسبية ثابتة أساسي من أجل دراسة التفاعلات بين الصلب والماء. هناك أربع تقنيات في الأصل توظف كثيرا من أجل الحفاظ على رطوبة نسبية ثابتة: | |||
1-محاليل ضمامية | |||
2-تعديلات حرارية من أجل محاليل مائية | |||
3-تحكم بالضغط الكلي فوق الصلب | |||
4-مزج بين تيارت هوائية رطبة وجافة | |||
تحقق المحاليل الملحية المشبعة و محالي | |||
ل حمض الكبريت رطوبة نسبية من خلال إنقاص ضغط البخار فوق المحاليل المائية ( تأثير ضمامي). تحافظ المحاليل الملحية المشبعة عند درجة حرارة متحكم بها على رطوبة نسبية ثابتة طالما أن الملح الفائض ومعظم المحلول متواجدون.عند إضافة الماء أو إزالة الماء من المحلول فإن الرطوبة السطحية إما أن تتكثف أو تتبخر(حسب ما يناسبه),مع ذوبان متتالي أو ترسيب للملح للحفاظ على توازن ضغط البخار. لأن درجة انخفاض ضغط البخار تعتمد على عدد الأنواع في المحلول و أكثر من ذلك بما إن الذوبانية لمعظم الأملاح بشكل ما تعتمد على درجة الحرارة فإن الرطوبة النسبية المتولدة أيضا تعتمد على درجة الحرارة.من الآن يمكن أن ينتج عن استخدام نفس الملح في درجات حرارة مختلفة رطوبات نسبية مختلفة. يمكن أن نعود إلى المراجع من أجل محاليل ملحية مشبعة معينة التي ينتج عنها رطوبات نسبية محددة كتابع لدرجة الحرارة. إنه من الأساسي أن يكون التشبع محققا سابقا للبدء بالتجربة لأن الرطوبة النسبية تعتمد على عدد الأنواع المنحلة. في هذا الصدد فإنه ينصح بتحضير المحلول الملحي قبل بداية دراسة الامتصاص. تستخدم محاليل حمض الكبريت بتراكيز مختلفة أيضا من أجل الحصول على رطوبات نسبية. إن إضافة أو إزالة الماء من المحلول بالتفاظ أو امتصاص الماء على الصلب يعدل من تركيز حمض الكبريت (والماء) في المحلول وبهكذا يغير الرطوبة النسبية لسطح السائل. تستخدم هذه التقنية عمليا للتحكم بالرطوبة النسبية على السطح بشكل أكبر عند امتصاص كميات صغيرة من الماء أو التفاظها من الصلب. | |||
يمكن أيضا استخدام تعديلات درجة الحرارة للمحاليل المائية للحفاظ على رطوبة نسبية ثابتة في الفراغ. تحافظ هذه التقنية على ان يكون الجسم الصلب في درجة حرارة واحدة والمحلول المائي المرتبط بالنظام في درجة حرارة اخرى. بسبب الاعتماد القوي لضغط البخار على درجة الحرارة فإنه من المطلوب أن يكون لدينا تحكم شديد بدرجة الحرارة للمحلول المائي و الجسم الصلب للحفاظ من خلال هذه التقنية على رطوبة نسبية ثابتة في جوار الجسم الصلب. | |||
كما يمكن أيضا استخدام التحكم بضغط البخار في الخلاء فوق الجسم الصلب من أجل الحفاظ على رطوبة نسبية فوق الصلب. كما هو موضح في المعادلة (4) ترتبط الرطوبة النسبية ارتباطا مباشرا بالضغط الجزئي للماء في الطور البخاري. لاستخدام هذه التقنية للتحكم بالرطوبة النسبية فإنه يجب أن يفرغ الخلاء فوق العينة تفريغا كاملا قبل التحليل .يمكن اعتبار بخار الماء النقي في الطور البخاري . بسبب تواجد بخار الماء فقط فإن الضغط المقاس فوق الجملة هو مرتبط بشكل مباشر مع الرطوبة النسبية فوق العينة. | |||
كما يمكن استخدام مزج هواء بخار الماء الجاف و المشبع في أبعاد معروفة من أجل توليد رطوبة نسبية ثابتة. إن التحكم بمعدلات التدفق و بمحتوى الهواء الجاف والمشبع من بخار الماء هو أساسي من اجل انتاج رطوبة نسبية دقيقة وقابلة لإعادة الإنتاج. | |||
===قياس الرطوبة النسيبة: Measurement of Relative Humidity=== | |||
يعتمد قياس الرطوبة النسبية على استخدام الجملة. الأنظمة التي تستخدم الخلاء تفرغ عادة قبل دخول بخار الماء. من أجل الحالات التي لا تحدث فيها تفاعلات تشكل البخار يمكن استخدام قياس الضغط الكلي في النظام كوسيلة قياس ضغط بخار الماء. | |||
تتطلب الأنظمة التي لم يفرغ فيها الهواء مقياس معين لضغط بخار الماء . (يجب أخذ الاحتياط في نموذج الأانظمة الوارد ذكره سابقا للتأكد من أن مصدر الرطوبة النسبية قريب بشكل تقريبي من الجسم الصلب بما أن انتشار بخار الماء في الهواء إلى الجسم الصلب مطلوب من اجل الحفاظ على رطوبة نسبية ثابتة في المحيط المجاور مباشرة للجسم الصلب). يتوفر تجاريا مجموعة واسعة من اجهزة قياس الضغط مع اختلاف في الدقة والصحة و الكلفة. | |||
====قياس الرطوبة النسبية الحرجة : Measurement of the Critical Relative Humidity, RH0==== | |||
يمكن تحديد الرطوبة النسبية التي يتميع عندها الجسم الصلب من خلال ثلاثة طرق: | |||
أولا: بشكل مباشر عن طريق قياس الرطوبة لنسبية فوق المحلول المشبع للمادة | |||
ثانيا :من خلال تحديد الرطوبة النسبية التي تكون عندما يترافق حدوث امتصاص لرطوبة معينة مع الانحلالية | |||
ثالثا: بشكل غير مباشر عن طريق قياس الحالة المستقرة لمعدل امتصاص الرطوبة عند رطوبة نسبية فوق الرطوبة النسبية الحرجة ومن ثم استقراء للرطوبة النسبية التي يكون عندها معدل امتصاص الرطوبة مساويا للصفر. | |||
على الرغم من أنه يمكن استخدام تقنيات أخرى من أجل قياس الرطوبة النسبية فوق المحلول المشبع فإنه يمكن القيام بعملية بسيطة نسبيا عن طريق تخلية الفراغ ( إزاحة الهواء عن طريق انتشار الطور البخاري) ومن ثم فصل مضخات الخلاء و الحفاظ على المحلول المشبع عند درجة حرارة ثابتة من أجل قياس ضغط بخار الماء. يمكن تحويل ضغط بخار الماء إلى رطوبة نسبية عن طريق من خلال التقسيم على p0 وهو ضغط بخار الماء فوق الماء النقي عند درجة الحرارة المطلوبة. | |||
====مقياس امتصاص الرطوبة (حرائك الميوعية) (Kinetics of Deliquescence) Measurement of Moisture Uptake==== | |||
يتطلب معدل امتصاص الرطوبة فوق الرطوبة النسبية الحرجة المحافظة وقياس لمجال من الرطوبة النسبية و القابلية لقياس محتوى الجسم الصلب من الرطوبة خلال مرور الوقت. يمكن تقليل انتشار الغاز خلال الفراغ باستخدام نظام الخلاء و بالتالي نستطيع الحفاظ على رطوبة نسبية ثابتة في المحيط المجاور للعينة. أيضا من أجل تقييم أكثر موثوقية للحالة الثابتة لمعدل امتصاص الرطوبة يحصل عندما يكون كامل الجسم الصلب سليما و تكون طبقة امتصاص الرطوبة رقيقة(على الأرجح مشبعة تقريبا)’ فمن المستحسن تحديد معدل امتصاص الرطوبة في فترات زمنية مبكرة. وفي هذا الصدد, إمكانية مشاهدة الجسم الصلب خلال التجربة مفيدة أيضا لإثبات الحفاظ على السلامة و بقاء الفائض من الجسم الصلب. | |||
قياس توازن امتصاص الرطوبة. Moisture Sorption Measurement of Equilibrium | |||
يمكن أن يتم توليد خط تساوي الحرارة لامتصاص و امتزاز الماء في بيئة رطوبة نسبية مراقبة إما حسب الثقل أو حسب الحجم. تتطلب طريقة الثقل النوعي : | |||
1-وزن العينة الجافة | |||
2-درجة حرارة ثابتة للعينة | |||
3-الحفاظ على الرطوبة النسبية الثابتة للعينة المحددة مسبقا | |||
4-تحقيق و قياس وزن بخار الماء الممتص عند التوازن. يمكن أن يحدث قياس ثقلي لامتصاص الرطوبة بشكل مستمر أو متقطع. يتطلب عادة القياس المستمر وضع العينة على توازن في الحرارة و بيئة الرطوبة النسبية المراقبة. و قد استخدم الميزان المكروي في الأنظمة المغلقة لهذا الغرض بنجاح, ويمكن أن تتحكم الأنظمة التجارية المتوفرة حاليا على وجه التحديد وبدقة بالرطوبة النسبية و بنفس الوقت تراقب وزن العينة. | |||
تتطلب الطريقة الحجمية: | |||
1-وزن العينة الجافة | |||
2-درجة حرارة ثابتة للعينة | |||
3-قياس ضغط بخار الماء في حجم الجرعات وبعد ذلك في الفراغ الموجود فوق العينة المتوازنة | |||
4-قياس الحجم الراكد للحجيرات المفردة بما فيها حجيرة العينة. جوهريا فإن الطريقة الحجمية توازن حجما صغيرا معلوما من الفراغ عند قيمة ضغط بخار ماء مقاسة يتبعها تعريض العينة قبل توازنها لهذا الماء مع قياس متتالي لضغط بخار الماء بعد التوازن . نحصل على كتلة الممتص∆n مقدرة بالمولات عند الضغط النهائي للنظام Pf من الفرق ∆p بين Pfcalc ضغط بخار الماء المحسوب عند التوازن وPfmeas ضغط بخار الماء النهائي المقاس | |||
حيث أن V هو الحجم النهائي و R ثابت الغازات وT درجة الحرارة المطلقة . | |||
====امتصاص الأجسام الصلبة البلورية للماء : WATER SORPTION BY CRYSTALLINE SOLIDS==== | |||
النموذج العام : General Model | |||
[[ملف:14.PNG]] | |||
يمتز الماء على سطح الأجسام الصلبة المتشكلة غير المتميهة عند رطوبة نسبية منخفضة.وبزيادة الرطوبة النسبية يتوقع ميل لحصول امتزاز متعدد الطبقات. سوف يبدأ الجسم الصلب بالانحلال في الطبقة الرقيقة الممتصة للماء عند رطوبة نسبية ( خاصة للمادة المعطاة ) سوف نحصل على الأغلب على محلول مشبع للمادة المنحلة, وهذا سوف يؤدي إلى تناقص ضغط البخار فوق الطبقة الرقيقة الممتصة للماء بشكل نسبي مع الماء النقي و أن يكون ثابتا ومساويا للضغط فوق المحلول المشبع للمادة. يمكن أن يعبر عن ضغط البخار كرطوبة نسبية حرجة RH0 | |||
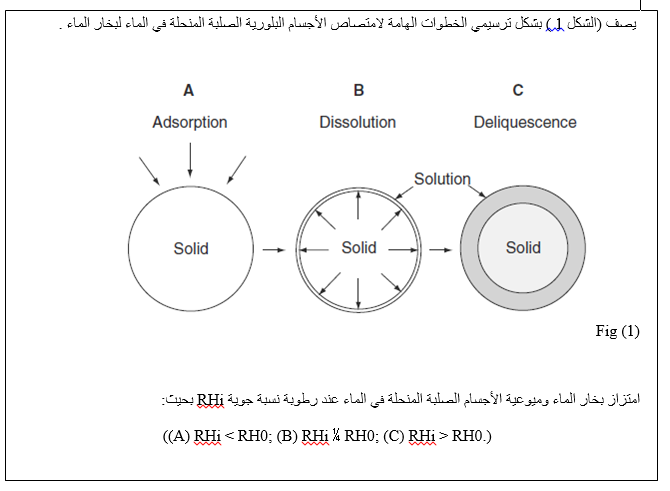
إذا كانت الرطوبة النسبية في الجو أكبر من الرطوبة النسبية فوق المحلول المشبع (RH0 )فإن الماء سوف يتكثف بشكل تلقائي فوق الطبقة الرقيقة المائية.هذا سوف يمدد الطبقة الرقيقة مما يسمح للمادة الصلبة أن تنحل مما يؤدي بدوره إلى الحفاظ على تدرج الضغط. سوف تستمر عملية امتصاص الماء إلى أن تنحل كل المادة الصلبة و إلى أن يحدث المزيد من تمدد المحلول. فقط عندما تزداد الرطوبة النسبية فوق المحلول لتساوي الرطوبة النسبية للجو فإن عملية الامتصاص سوف تنتهي. تسمى هذه الظاهرة بالميوعية. على الرغم من أن المادة المميهة تخضع لتحول الحالة الصلبة عن طريق الانتقال من الحالة الغير مميهة إلى الحالة المميهة كما هو الحال في الانتقال من أنواع حالة مميهة إلى أخرى. يلاحظ أيضا سلوك مشابه لذلك الموصوف سابقا للمواد المميهة عند رطوبة نسبية حرجة للمواد المميهة وفوقها. تتواجد في الأنظمة الصيدلانية أنواع منحلة في الماء بكثرة في الأشكال الصيدلانية . لذلك من الضروري فهم الشروط المسؤولة عن الميوعية و فهم الحالات الجزيئية التي تحدث عند رطوبة نسبية تحت نقطة التميع. | |||
====امتصاص الماء فوق الاجسام غير المميهة تحت الرطوبة النسبية الحرجة: Water Sorption onto Non-Hydrates below RH0==== | |||
يعتمد امتصاص الماء فوق الاجسام غير المميهة البلورية تحت الرطوبة النسبية الحرجة على قطبية السطح و سوف يكون متناسبا مع مساحة السطح. كمثال على ذلك يظهر الماء ميلا صغيرا للامتصاص على الاجسام الصلبة غير القطبية كالكربون والتيفلون ( متعدد رباعي فلور الإيتيلين ) ولكنه يمتص بشدة أكبر على المواد الأكثر قطبية كالهاليدات القلوية و الأملاح العضوية كساليسيلات الصوديوم. ولأن الماء يمتص فقط على السطح الخارجي لهذه المواد فإنه تمتص كميات صغيرة نسبيا من الماء ( عادة أقل من 1 ملغ في كل غرام ) مقارنة مع المواد المميهة والغير بلورية التي تمتص الماء إلى بينتها الداخلية. | |||
لسوء الحظ اقتصدت المطبوعات على إيراد أمثلة تظهر صورة لامتصاص الماء على المواد البلورية الغير متميهة تحت الرطوبة النسبية الحرجة. وهذا على الأغلب عائد للصعوبة في القياس الدقيق لكمية الماء الصغيرة الممتصة. ويستثنى من ذلك الهاليدات القلوية نتيجة تخصص جزيئاتها مورفولوجيا . يظهر الشكل (2) خط تساوي الحرارة لامتصاص الماء على كلور الصوديوم المعاد بلورته. لاحظ أن هناك كمية من الماء تمتص كتابع للرطوبة النسبية مساوية لمساحة سطح نوعية للعينة. ولأن الماء يمتص فقط على السطح الخارجي للمادة فإن ذلك يسمح بمقارنة بيانات امتصاص الماء من خلال عدة مواد مختلفة , بينما ربط هذه البيانات على أسس بكل غرام ستكون بلا معنى أو ذو معنى قليل. | |||
[[ملف:15.PNG]] | |||
Fig(2) | |||
امتصاص بخار الماء لكلور الصوديوم الأساسي و كلور الصوديوم المعاد بلورته. | |||
Water vapor sorption for recrystallized ( ) and | |||
ground ( ) sodium chloride at 20_C. (From Ref.[48]). | |||
. يمتص 5 × 10_4 g water/m2 فقط من عينة كلوريد الصوديوم وذلك من أجل عينة كلوريد الصوديوم الموجودة في الشكل 2 (مساحتها السطحية النوعية= 0.0875 m2/g من اجل دراسات الامتزاز على الكريبتون ) وحتى أنه يصل إلى70% من الرطوبة النسبية. وأيضا نلاحظ الطبيعة الخطية الظاهرة لخط تساوي الامتزاز. | |||
من أجل بيانات تحليل BET للامتزازعند درجة رطوبة نسبية أخفض فإننا نحصل على قيمة Wm مساوية | |||
ل 7.6 × 10_5 g/m2 | |||
هذه القيمة هي فقط 0.32 من القيمة المتوقعة من أجل تغطية طبقة واحدة بافتراض أن مساحة جزيء الماء تساوي 12.5Å2 .وهذا يشير إلى انه لا فائدة من الإشارة إلى عدد الطبقات من الماء الممتز كمتعدد للقيمة Wm إلا كنقطة مرجعية. | |||
وبشكل مثير للاهتمام فإن الارتفاع في الخطوة الثانية في الشكل2 يحصل عندما يكون محتوى الرطوبة تقريبا مساويل لثلاثة أضعاف عنه من المناظر لقيمة Wm مشيرا إلى انه من أجل عينة كلوريد الصوديوم فإن الطبقة الاحادية تكون فعلا مكتملة عند الخطوة الثانية من خط تساوي الحرارة. | |||
تشيرنتائج حرارة الامتصاص !! لعينة كلوريد الصوديوم من Barraclough and Hall إلى أن حرارة الامتصاص من اجل الماء عند قيم تصل إلى القيمة Wm تكون ثابتة بينما تنقص حرارة الامتصاص وتصبح ثابتة عند ضعف قيمة Wm تقريبا. | |||
وباعتبار الخطأ الموجود عند الحصول على قيم . Wm و حرارة الامتصاص!! فإن هذا يشير إلى الماء يمتص بواسطة طاقة رابطة متجانسة عند القيم التي تصل إلى Wm ثم يتفاعل بحد أقل من ذلك حتى يتم تشكيل الطبقة الأحادية. | |||
كما يظهر في الشكل 2 وأيضا في عمل Barraclough and Hall فإن امتصاص الرطوبة على كلوريد الصوديوم كتابع للرطوبة النسبية هو تابع عكوس طالما أننا لم نحصل على القيمة RH0 هذا دليل على أن انحلال المادة البلورية في الماء لا يتم عند درجة رطوبة نسبية أقل من RH0 وهذا يتماشى مع العقلانية التيرموديناميكية بأن الانحلال تحت الدرجة RH0 سوف يتطلب محلولا فوق مشبعا ( أن عددا متزايدا من الأنواع في المحلول سوف يكون ضروريا من أجل حث الانحلال عند درجة رطوبة نسبية تحت تلك الدرجة التابعة للمحلول الفوق مشبع RH0 ) .في هذا الخصوص يجب علينا ان نضع في الحسبان خواص الحالة الصلبة للمادة البلورية النقية تحت درجة. RH0 | |||
وكما يوصف بدقة بأنه ربما سيتم أخذ اعتبارات أخرى من اجل مادة موجودة في أشكال بوليميرية متعددة أو أنها تمتلك مواد لابلورية. | |||
====امتصاص الماء على الأجسام المميهة تحت درجة الرطوبة النسبية: Water Sorption onto Hydrates below RH0==== | |||
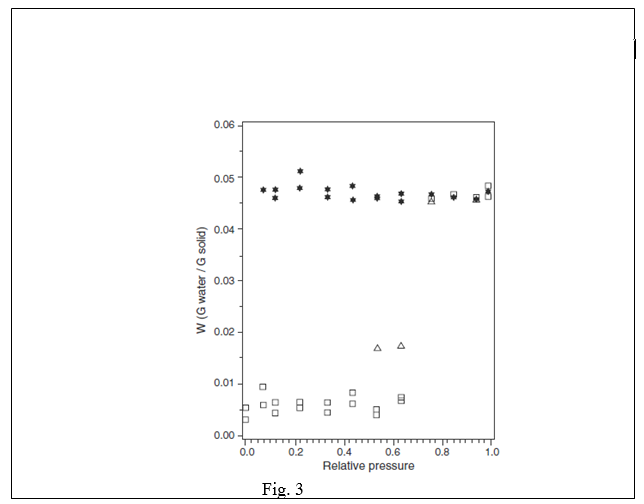
تستخدم العديد من الأدوية والسواغات ( السيفاليكسين أحادي التميه و كبريتات الكيندين ثنائية التميه و الأمبيسيلين ثلاثية التميه و كبريتات الكودئيين ثلاثية التميه و كبريتات المورفين ثنائية التميه و فوسفات ثنائي ا لكالسيوم ثلاثية التميه والرافينوز خماسي التميه و اللاكتوز أحادي التميه) الماء كجزء تام من بنيتها البلورية. تميل الأجسام الصلبة التي تشكل بلورات مميهة معينة إلى امتصاص كميات صغيرة نسبيا من الماء على سطحها الخارجي تحت درجة رطوبة نسبية مميزة وذلك عند تجفيفها بداية إلى حالة غير مميهة. تسلك هذه المواد سلوكا مشابها للمواد الغير متميهة تحت هذه الدرجة من الرطوبة النسبية. عند الوصول إلى هذه الدرجة المميزة فإن أي زيادة من الماء إلى النظام لن تؤدي إلى إلى زيادة أخرى في الرطوبة النسبية. في الواقع فإن هذا الماء سيمتص وبالتالي ستتحول البلورة الغيرمتميهة إلى متميهة. تعتمد قوة التفاعل بين الماء والجسم الصلب على مستوى الرابطة الهيدروجينية الممكنة ضمن الشبكة. في بعض المواد المميهة ( الكافئين و التيوفيلين ) حيث تكون الرابطة الهيدروجينية فيها ضعيفة بشكل نسبي تستطيع جزيئات الماء أن تساعد في الحفاظ على ثبات التميه بشكل أساسي تبعا لقاعدة ملء الفراغ. بماأن جزيئات الماء تشغل مواقع نظامية ضمن شبكة المادة المميهة مع أمثال تفاعل معينة( مثال : 1:1 أحادي التميه و 2:1 ثنائي التميه و 5:1 خماسي التميه ) للمادة الصلبة فلذلك تمتص كميات كبيرة من الماء. يوضح الشكل 3 خط تساوي الحرارة لامتصاص الرطوبة لمادة بروميد الايبراتروبيوم. يجري على هذه المادة تميه ظاهري للبلورات بين 63% و 75% من الرطوبة النسبية . إن 4.6% من الماء تقريبا يمتص فوق نسبة 75% من الرطوبة النسبية ( نظريا 4.4% لأحادي التميه ) بشكل مثير للاهتمام فإن بروميد الايبراتروبيوم يصل إلى التوازن بعد فترات زمنية طويلة ( مثال من شهرين إلى خمسة أشهر على التوالي كما هو موضح في الشكل 3 ) يبدو أن تميه البلورات يظهر عند 53% و 63% من الرطوبة النسبية. | |||
[[ملف:17.PNG]] | |||
خط تساوي الحرارة لامتصاص والتفاظ الماء لبروميد الايبراتروبيوم عند درجة الحرارة 20 سيليسوس | |||
حيث : | |||
( ) نتائج الامتصاص بعد شهرين , ( ) نتائج الامتصاص بعد خمسة أشهر ,( ) نتائج الالتفاظ بعد شهرين إلى خمسة أشهر | |||
( ملاحظة: نتائج الامتصاص بعد شهرين عدا عند 53% و 63% من الرطوبة النسبية تؤكد صحتها بعد خمسة أشهر. ) | |||
يظهر هذا المثال بشكل واضح أن فترة عدة أشهر مطلوبة من أجل تحقيق امتصاص توازني عند درجة رطوبة نسبية منتقاة. كميزة للعديد من المواد المميهة, يظهر بروميد الايبراتروبيوم تلاكؤ ذو قيمة بين خط تساوي الحرارة للامتصاص وللالتفاظ. يعود هذا إلى درجة الارتباط والتعبئة الفيزيائية للماء في الشبكة المميهة. | |||
يجب الأخذ بعين الاعتبار التميه الغير محدد أو التميه للشبكة البلورية من دون تحول الطور من المرتبة الأولى. قدم Cox, Woodard, and McCrone تقريرا عن امتصاص الرطوبة لكرومولين الصوديوم و التأثيرات المرتبطة على الخواص الفيزيائية لهذه المادة. على الرغم من أنه تمتص تسعة جزيئات من الماء في كل جزيئ كرومولين الصوديوم ضمن الشبكة البلورية عند 90% درجة رطوبة نسبية فإنه لاتظهر مخطط الامتصاص أي قمة حادة مرتبطة بالتميه الثابت . في الواقع يظهر مخطط الامتصاص زيادة تدريجية في محتوى الرطوبة عند تزايد الرطوبة النسبية التي تظهر كتغير واضح في نموذج الانحراف للأشعة السينية و كتغير في الكثافة وكتغير في خواص فيزيائية أخرى. من أجل هذا المثال يرتبط امتصاص الرطوبة على كرومولين الصوديوم مع انتباج الشبكة البلورية من وجهة نظر علم البلورات والتي ظهر أنها عكوسة بنزع الماء. | |||
من خلال فهم عميق لمخطط التميه لمادة صلبة فإن تشكيل بلورةمميهة مهم لعدة اسباب أولها لأن المادة الغير مميهة والمواد المميهة هي أنواع مميزة ترموديناميكيا وسيكون لها خواص فيزيائية وكيميائية مختلفة ( مثال : الانحلالية) والتي قد تؤثر في الانحلال والتوافر الحيوي وثانيا فإن أنواع مواد مميهة مرغوب بها يمكن تشكيلها واستخدامها و حفظها ببساطة من خلال التحكم بالشروط البيئية المحققة. وثالثا لأن كميات معينة من الماء يمكن امتصاصها تصبح مميهة ويمكن تحرير الماء منها لتصبح مواد غير مميهة لذا الخواص الفيزيائية والكيميائية للنظام الحالي ( المتضمن في جواره أجسام صلبة أخرى) يمكن ان تؤثر بشكل واضح. | |||
==الرطوبة النسبية الحرجة The Critical Relative Humidity, RH0== | |||
إن معرفة قيمة الرطوبة النسبية الحرجة لكل مكون في الصيغة و للنظام بأكمله هو مهم جدا للتنبؤ بالرطوبة النسبية حيث تتوقع التغيرات الفيزيائية العيانية للنظام و التي تعود إلى انحلال المكونات المنحلة بالماء. تتأثر قيمة الرطوبة النسبية الحرجة كخاصية ضمامية بشكل كبير بعدد الأنواع الموجودة في المحلول. وكقاعدة عامة ، يمكن إجراء تعليقين عامين. الأول أن المركبات التي اتبدي انحلالية قليلة بالماء تملك بشكل نموذجي قيمة للرطوبة النسبية إلى حد بعيد أعلى من 95% من الرطوبة النسبية. و الثاني أنه كلما تزداد الانحلالية تنقص الرطوبة النسبية الحرجة RH0. | |||
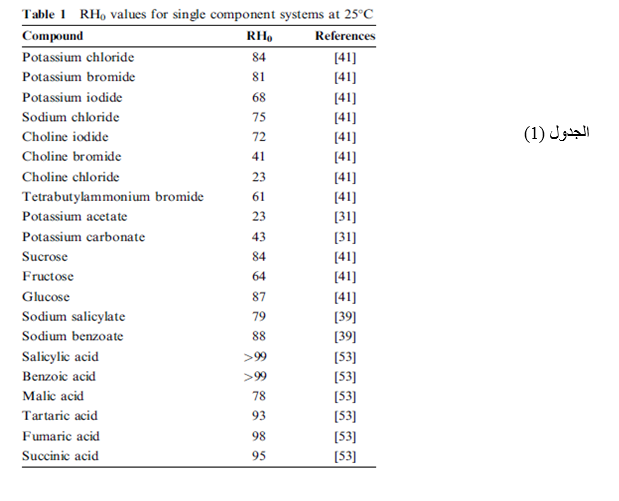
بما أن السوائل غير المثالية تظهر على شكل محاليل تصبح مركزة أكثر وأكثر فإنه ليس من المحتمل عادة أن يستخدم نماذج محاليل تمييع ( كمثال قانون (Raoult’s للتنبؤ بدرجة الرطوبة النسبية المتوقعة للمنحل الذي يملك انحلالية معينة في الماء ,لذا يجب قياس الرطوبة النسبية الحرجة RH0 لكل جسم صلب بمفرده. يظهر في الجدول (1) أمثلة لقيم الرطوبة النسبية الحرجة لمكونات النظام مفردة. | |||
[[ملف:18.PNG]] | |||
من جهة أخرى, يمكن حساب قيم RH0 للمزيج من قيم الـ RH0 للمكونات المفردة باستخدام المعادلة المكتشفة من قبل Ross | |||
[[ملف:15..PNG]] | |||
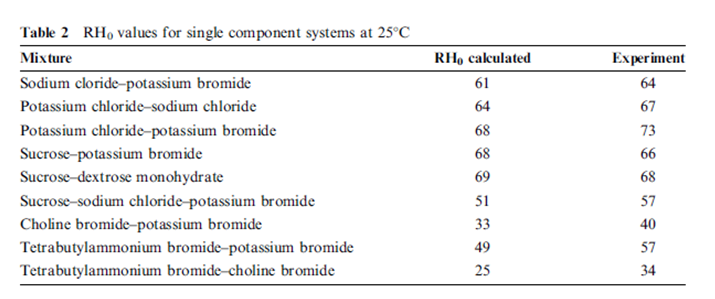
حيث ( RH0)mix هي الرطوبة النسبية فوق المحلول المشبع من المزيج و (RH0)i تمثل الرطوبة النسبية للمحاليل الملحية المشبعة المفردة. تشتق معادلة روس بفرض أن المحلول ممدد و أن التفاعل بين مكونات المحلول مهمل. تقارن النتائج الواردة في الجدول (2) قيم RH0 المكتسبة من حساب قيم الـ RH0 للمزيج من معادلة روس و قيم الـ RH0 المكتسبة عن طريق التجربة. | |||
توافق النتائج هو شيء جيد جدا و خاصة باعتبار المستويات العالية لانحلال المواد المنحلة التي تم الوصول إليها تقدر بأنها عالية ك 50 مولالية بالنسبة ل : | |||
لنظام بروميد الكولين إلى بروميد رباعي بوتيل الأمونيوم((the choline bromide/tetrabutylammonium bromide system | |||
[[ملف:19.PNG]] | |||
==حرائك الميوعية فوق الرطوبة النسبية الحرجة. The Kinetics of Deliquescence above RH0== | |||
اقترح العمل البدئي الذي قام به Edgar و Swan وAdams و Merz و Prideaux و Morkowitz و Boryta و Carstensen أن معدل امتصاص الرطوبة للأجسام المنحلة بالماء فوق الـRH0 يجب أن يعتمد على الفرق بين الضَّغْطُ الجُزْئِيّ للماء في الوسط المحيط و بين الضغط الجزئي للماء فوق المحلول المشبع من المادة المنحلة بالماء و يعتمد أيضا على درجة الحرارة و على مساحة السطح المعرضة من المادة الصلبة وعلى سرعة الحركة للهواء الندي و على ثابتة التفاعل المحددة التي تكون مميزة لكل جسم صلب على حدا. | |||
طورالعلماء Van Campen و Amidon و Zografi نماذج تصف معدل امتصاص الرطوبة فوق الـ RH0الذي يعتمد نقل كتلة الماء إلى المادة الصلبة و انتقال للحرارة بعيدة عن السطح. لأجل الحالات الخاصة للبيئة المكونة من ماء نقي (كشروط الخلاء البدئية), بُسط نموذج الـ Van Campen و Amidon و Zografi كثيرا وذلك بسبب عدم الحاجة لاعتبار انتشار البخار. يفترض هنا للمعدل الذي عنده تنتقل الحرارة بعيدة عن السطح أن يكون عامل مهم لتحديد معدل الامتصاص W. لهذه الحالة الخاصة , يشتق المصطلح ليعبر عن معدل امتصاص الرطوبة كتابع فقط للرطوبة النسبية للمحيط RH1 و RH0. | |||
ظهر هذا النموذج ليكون قابل للتطبيق من أجل وصف حرائك امتصاص الرطوبة (في الخلاء) فوق الـ RH0 من أجل أنظمة المكون المفرد من الألدهيدات القلوية و السكاكر و أملاح الكولين. | |||
امتد هذا النموذج مؤخرا لأخذ بعين الاعتبار حرائك امتصاص الرطوبة فوق الـ RH0 من أجل أنظمة المكونات المتعددة لهذه المواد. | |||
==امتصاص الماء بالأجسام الصلبة الغير بلورية: WATER SORPTION BY AMORPHOUS SOLIDS== | |||
===تحليل خط تساوي الحرارة عند درجات حرارة المحيط. Isotherm Analyses at Ambient Temperatures=== | |||
إن كمية الرطوبة الممتصة من قبل الأجسام الصلبة الغير بلورية أكثر بشكل قياسي من كمية الرطوبة الممتصة من قبل المواد البلورية الغبر مميه تحت درجة رطوبتها النسبية الحرجة. تضم المواد النموذجية فيما بتعلق بالاهتمام الصيدلاني السيلليلوز و النشاء و متعدد (فاينيل البيروليدون) و الهلام و بعض البروتينات المجمدة. على الرغم من أن بعض هذه المواد تظهر خاصية بلورية بشكل جزئي فإنها تحتوي بشكل عام على أجزاء معتبرة من المادة الغير بلورية ولذا ضمت إلى هذا الصنف من المواد. يظهر في الشكل 4 خط تساوي الحرارة النموذجي للسيللوز البلوري المكروي. لاحظ أن الكميات المعتبرة من الماء الممتصة خلال كامل مجال الرطوبة النسبية و أن كلا خطوط تساوي الحرارة للامتصاص و الالتفاظ تُميز بشكل حرف S التقليدي غالبا تلاحظ عند الادمصاص الفيزيائي للغازات. و الظاهر أيضا هو التلاكؤ بين أقسام الامتصاص و الالتفاظ لخط تساوي الحرارة (ككمية الماء المرتبطة بالمادة الصلبة هي أكثر لخط تساوي الحرارة للالتفاظ منه للامتصاص و ذلك لأجل رطوبة نسبية محددة) . هذا نموذجي لهذه الأنواع من المواد و تنسب بشكل عام إما إلى تأثيرات الحرائك أو للتغيير في هيئة سلاسل البوليمر الناتجة عن تأثيرات التلدن للماء الممتص. | |||
يظهر الشكل 4 التوافق الممتاز لمعادلةGAB لخط تساوي الحرارة لامتصاص و التفاظ السيللوز البلوري المكروي. في هذا الموضوع, قدمت هذه المعادلة استعمالا تطبيقيا معتبرا لتناسب خط تساوي الحرارة لهذه الأنواع من المواد خلال كامل مجال الرطوبة و خصوصا بالمقارنة مع معادلة BET التي تلائم عادة فقط معطيات الامتصاص التي تصل تقريبا لـ 40% من الرطوبة النسبية. و مع ذلك كما ذكر سابقا فهي لا تلائم بحد ذاتها المصداقية لنموذج GAB لأجل وصف معطيات امتصاص الرطوبة لهذه المواد. في الواقع فإن بيانات غير معتمدة للطرائق الفيزيائية تكون ضرورية | |||
اكتسبت النظرية المادية المعتبرة في آلية الربط الأولي للماء على النشاء و السيللوز من تحليل خط تساوي الحرارة و التي تعطي قيم ل Wm و يتضح ذلك في الجدول 3 الذي يعطي قيم Wm لأنواع النشاء الثلاثة. ويبين الجدول 3 أن قيم Wm ثابتة تماما على الرغم من الاختلافات الشكلية المعتبرة بين مختلف النشويات. و يبدو أن قيمة واحدة من Wm المأخوذة من نوبة معطيات الالتفاظ أعلى بقليل من القيم المأخوذة من بيانات الامتصاص. | |||
[[ملف:20.PNG]] | |||
خط تساوي الحرارة لامتصاص بخار الماء ( ) و التفاظ بخار الماء ( ) للسيللوز البلوري المكروي عند 20 درجة سيلسيوس | |||
Solid line: GAB fit to sorption Data | |||
Dashed line: GAB fit to desorption data. | |||
هذا من المتوقع أن يكون إذا حدث تزايد في توافر مواقع الامتصاص الأولية عن طريق تعرض سابق لارتفاع رطوبة نسبية مع تزايد متتالي لمستويات امتصاص الماء. كما هو موضح في قاعدة Van den Berg et al. وآخرون ’ تقترب هذه القيم لـ Wm للقيمة 0.11 غرام من الماء من أجل غرام واحد من النشاء المحسوبة بافتراض امتصاص جزيء ماء واحد لكل وحدة غليكوز منزوعة الماء. بما أن هذه الحسابات تفترض توافر جميع وحدات الغليكوز منزوعة الماء للارتباط الأولي وبما أنه ليس من المرجح أن تكون هذه هي الحالة على وجه التحديد ’ فإنه ليس من المستغرب أن هذه القيم المقاسة لـ Wm هي أقل قليلا من 0.11 غرام /غرام. | |||
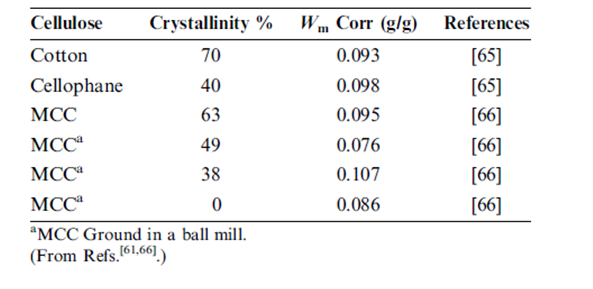
وقد وسع Zografi et al وآخرون هذا التحليل إلى امتصاص الماء بمواد مختلفة من السيللوز. التصحيح ضروري من أجل السيللوز وذلك لأن بخار الماء يحتل فقط المناطق اللابلورية. يبين الجدول 4 قيم Wm المستمدة من تحليلات خط تساوي الحرارة لمواد سيللوزية متعددة بعد إجراء حساب لدرجة التبلور. كما هو متوقع يظهر السيللوز ذو درجات مختلفة من التبلور قيم مختلفة من Wm بدون تصحيح لمعدل التبلور وهي كلها أقل إلى حد كبير من Wm المحسوبة للنشاء. ومع ذلك عند التصحيح لدرجة التبلور فإن جميع قيم ال Wm تكون على توافق منطقي مع بعضها البعض ومع قيم الـ Wm المستمدة من النشاء. مما يثير الاهتمام بشكل خاص النتائج الموجودة في الجدول 4 لعينات السيللوز البلورية المكروية التي تملك درجات مختلفة من التبلور العائدة إلى الطحن. تشير هذه النتائج إلى تشابه آلية قبط الماء التي تحدث في النشاء وفي المناطق غير البلورية للسيللوز. | |||
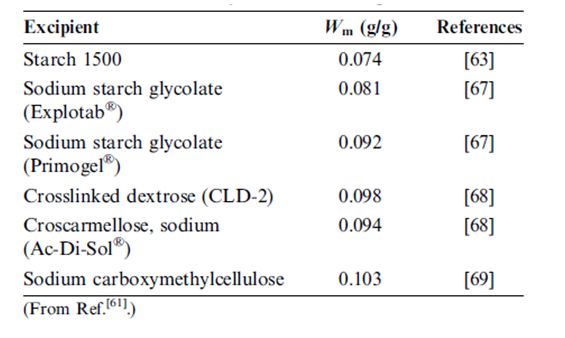
وترد تحليلات مشابه لبيانات قبط الرطوبة في (الأدب) لمشتقات النشاء و السيللوز الأخرى المستعملة كسواغات صيدلانية الموجودة في الجدول رقم 5. إذا أخذنا بعين الاعتبار الالتباس المرتبط مع قيم قبط الرطوبة المقدرة من الخط البياني المنشور نجد تناسق تام لجميع قيم الـ Wm مع بعضها البعض ومع الأمثال الاستيكومترية لجزيء ماء واحد لكل وحدة سكرية لا مائية. ومن المثير للاهتمام أن نلاحظ أن العينتين المشتقتين من السيللوز (كَرْبُوكْسِي ميثيل سيللوز الصودي و كربوكسي ميثيل سيللوز الصودي المتصالب) لا يتطلبان أي تصحيح لدرجة التبلور لتتطابق بشكل دقيق مع الأمثال الاستيكيومترية 1:1 وبالتالي يبدو من المرجح تماما أن التغير في البنية الكيميائية و في معالجة هذه المواد يلغي بشكل أساسي تبلور السيللوز. | |||
يشير التحليل السابق فعلا إلى نفاذ الماء في أرجاء المناطق الغير بلورية لهذه المواد و خضوعه لتفاعل محدد مع مواقع الامتصاص المتوافرة ,على الأرجح مجموعات الهيدروكسيل المتاحة , على وحدات الغليكوز الغير مائية. يدعم هذا النموذج اختلاف الحرارة في الامتصاص الناتجة من مواد نشوية و سيللوزية مختلفة. | |||
الجدول 4 : | |||
قيم Wm للسيلوز متنوع مأخوذة من تحليل BET لخط تساوي الحرارة لامتصاص الرطوبة المصصحة صححت من أجل درجة تبلور. | |||
[[ملف:21.PNG]] | |||
الجدول 5: | |||
قيم Wm لصواغات صيدلانية متنوعة مأخوذة من تحليل BET لخط تساوي الحرارة لامتصاص الرطوبة | |||
[[ملف:22.PNG]] | |||
تشير البيانات المجموعة إلى أن هناك تفاعل محدد بين المادة الصلبة و الماء حسب محتوى الرطوبة وهو يعادل على الأقل ثلاث أضعاف الـ Wm. يظهر الماء الموجود في النظام خلال هذا النطاق ليبقى في حالة أكثر تنظيما (على سبيل المثال أقل حركة) من كتلة الماء .من المثير للاهتمام , تظهر حرارة الامتصاص فواصل غير مترابطة مترافقة مع الأمثال الاستيكومترية لجزيء أو جزيئين ماء لكل وحدة غليكوز غير مائية. تشير بعض اختلافات حرار الامتصاص الناتجة التي تبقى تقريبا ثابتة خلال مجال الـ Wm إلى تجانس الارتباط خلال هذا المجال. ومع ذلك هذا لايحدث دائما. و تم إثبات ذلك من خلال بيانات حرارة التبخرعلى عينات السيللوز المصرح عنها من قبل Etzler وConners | |||
تزداد حرارة الانتزاز للماء من القالب بشكل مستمر كما قيس باستخدام DSC/TGA معا عندما يقل محتوى الرطوبة عن حوالي ( نصف غرام ماء لكل غرام سيللوز) تقريبا (حوالي ثلاثة أضعاف من Wm ) , تشير هذه النتائج إلى أن وجود الماء في عدة حالات مختفلة طاقيا. | |||
يوجد دليل داعم آخر لتفاعل محدد للمادة الصلبة مع الماء من خلال دراسات حرارية تظهر كمية الماء غير القابل للتجمد و الطنين المغناطيسي الذري ودراسات الانتشار. هذا الدليل غير واضح في خصوص إذا كان هناك ارتباط محدد للماء مع مواقع الامتصاص فإن الماء يتصرف بدرجة حركة مقبولة وبالتالي يشكك في استخدام مصطلح ( الماء المرتبط ) . | |||
===تحليل خط تساوي الحرارة كتابع للحرارة Isotherm Analyses as a Function of Temperature=== | |||
وبصفة عامة ، ينقص امتصاص الماء على الأجسام الصلبة الغير متبلورة كتابع للرطوبة النسبية كلما زادت الحرارة مما يعكس طريقة إجمالية ناشرة للحرارة ويتوقع بشكل طبيعي مع عمليات امتصاص البخار. ويلاحظ هذا السلوك مع السيللوز و النشاء و متعدد فينيل البيروليدون و متعدد ميتيل الميثاكريلات. ويفترض في مثل هذه الحالات أن العامل المسيطر هو غالبا الحرارة السلبية للامتصاص الناشئة من التغير في مدى ربط الماء. ومع ذلك فإن العملية هي أعقد من ذلك وذلك بسبب تغير في الشكل و بالتالي تغير في العشوائية. ويمكن ملاحظة تعقيد آثار الحرارة على امتصاص بخار الماء و الروابط الممكنة للتأثيرات الملدنة للماء في عمل Oksanen و Zografi اللذين سجلا تناقص قيم الـ Wm لمتعدد فينيل البيريلدون خلال مجال الحرارة 40 -60 درجة سيليسوس ثلاثة مرات مشيرا إلى أن قيمة Wm لا تعكس الرقم المطلق لمواقع الارتباط المتاحة على البوليمير ضمن مفهوم " الماء المرتبط" بالإضافة إلى أنه يظهر هناك صلة بين Wm و W (درجة الانتقال الزجاجيTg=T هي درجة كمية الماء الممتص الذي سيخفض درجة الانتقال الزجاجي إلى درجة حرارة العينة بمعدل W(Tg = T)/Wm الذي يبقى ثابتا تقريبا عند 3.0 خلال مجال الحرارة الكامل. | |||
كملخص لما سبق أن الماء يمتص على البوليمير اللابلوري إلى حد معين . يحدث التفاعل لجزيئات الماء مع مواقع الامتصاص المتاحة عن طريق الروابط الهيدروجينية مما يسبب انخفاضا في حركية الماء الممتص وتغيرا ملحوظا في الحالة الترموديناميكية للماء نسبة إلى كتلة الماء . ومع هذا يظهر أن نفوذية الماء إلى جميع مواقع الامتصاص المتاحة تكون معتمدة على التاريخ السابق و الخواص الفيزيائية والكيميائية للمواد الصلبة.وفي هذا الخصوص فإن تفاعل المادة الصلبة مع الماء في انظمة البوليميرات اللابلورية هو علاقة ديناميكية معتمدة بشكل قوي على فعالية الماء ودرجة الحرارة. | |||
==معنى مساحات السطح النوعية من خلال دراسات امتصاص الماء: | |||
Areas Calculated from Water Absorption Studies Teh Meaning of Specific Surface== | |||
يوصلنا ببساطة حساب مساحات السطح النوعية من خلال قيم Wm الموجودة في الجداول3-5 إلى مساحات سطح نوعية ظاهرية تعادل تقريبا 300–500m2/gولكن مساحات السطح النوعية المأخوذة من تحليلات مشابهة لدراسات امتزاز أجريت على غازات لا قطبية ( نتروجين أو كريبتون) هي بشكل مطابق مستقلة عن معالجة العينات خلال المجال 1m2/g. | |||
وبشكل مثير للاهتمام أظهرت دراسات طحن الكرة التي أجراها العالم Nakai على السيللوز الميكرو بللوري ( الجدول 4) أن قيم... المأخوذة من دراسات امتصاص الماء تزداد إلى حد كبير أكثر من الازدياد الحاصل في مساحة السطح بسبب تفتيت العينة. في الحقيقة وكما تم مناقشته سابقا فإنه ظهر تناسب بين امتصاص الماء مع مقدار الصفة اللابلورية مشيرا إلى أن الماء يمتص من خلال المناطق اللابلورية للمادة. في هذا الخصوص تؤخذ مساحات السطح النوعية للمواد الصنعية إذا حسبت من بيانات امتصاص الماء لهذه الأانواع من المواد. | |||
==دور الماء كعامل ملدن: The Role of Water as a Plasticizer== | |||
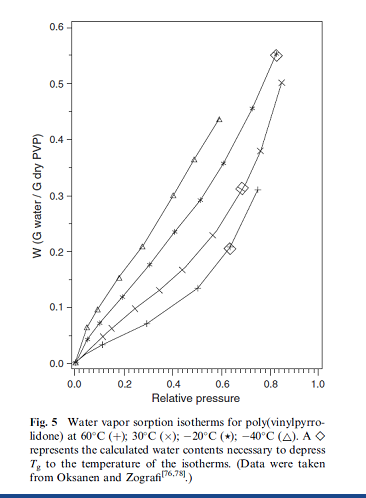
يظهر امتصاص البنية الداخلية للمادة الصلبة لكميات معتبرة من الماء تأثيرا على خواص المواد الصلبة. يتوضح ذلك على سبيل المثال من خلال التلاكؤ الملاحظ بين خط تساوي الحرارة للامتصاص والالتفاظ الموجود في الشكل4. تصبح هذه الظاهرة مبالغا بها إلى حد كبير في المواد المكونة من نسب عالية من المواد اللابلورية .شرح. Levine و Slad أن الماء ذو درجة انتقال زجاجي منخفضة جدا يمكن أن يتصرف كعامل ملدن لأنه يخفض درجة الانتقال الزجاجي للبوليميرات اللابلورية. كما يلاحظ سلوك مشابه لذلك في المواد الصلبة اللابلورية ذات الأوزان الجزيئية المنخفضة. كما تم ملاحظته فإن الخواص اللزجة للمود الصلبة تتغير بشكل معتبر فوق درجة الانتقال الزجاجي ( الحالة المطاطية) نسبة إلى تحت درجة الانتقال الزجاجي ( الحالة الزجاجية) فإنه غالبا ما يطرأ على المادة الصلبة تغييرات في الخواص الفيزيائية عند محتويات رطوبة معينة ودرجات حرارة محددة كنتيجة لهذه الظاهرة. وقد أظهر .....على البولي فينيل بيرليدون أن محتوى الرطوبة عندما يبدأ خط تساوي الحرارة بالتزايد بشكل ملحوظ يرتبط بشكل جيد مع محتوى الرطوبة الذي سوف يقلل الـ Tg إلى درجة حرارة خط تساوي الحرارة. ويتضح ذلك في الشكل 5 الذي يظهر خط تساوي الحرارة لامتصاص الماء للبولي فينيل البيرليدون خلال مجال الحرارة من( -40 إلى 60.درجة مئوية). بشكل واضح فإن نقطة الالتواء التي يبدأ عندها خط تساوي الحرارة بالانقلاب نحو الأعلى بشكل ملحوظ إلى محتوى أعلى من الرطوبة عندما تتناقص الحرارة. ولتوضيح ذلك, لاحظ أن محتوى الرطوبة الضروري (0.674غرام لكل غرام) لإنقاص ال Tg إلى -40 درجة سيلسيوس لم يظهر في الشكل 5 و يبدو خط تساوي الحرارة أنه خطي فعلا على مجال الرطوية النسبية المعروض. ولمزيد من الإيضاح, فإن محتوى الرطوبة [W(Tg = T)] الموافق لـ Tg عند 60,30, 20- , -40درجة سيليسوس يظهر بحوالي 0.205,0.313, 0.553و 0.674 غ لكل غرام بالتوالي. و ذكر Oksanen و Zografi أن السيللوز و بروتين الإلستين يبدي علاقة مماثلة عندما يتوافق التحول من زجاج إلى مطاط مع الالتواء التصاعدي في خط تساوي الحرارة الخصوصي. | |||
[[ملف:23.PNG]] | |||
وأثبتت الدراسات المتتالية عن طريق Hancockو Zografi أن درجة حرارة الانتقال الزجاجي لـ PVPو سيللوز الميتيل و متعدد ميتيل الميتاأكريل تنخفض بشكل خطي بجزء الوزن للماء الممتص وفقا لمعادلة Gordon–Taylor/Kelly–Bueche المبسطة. | |||
[[ملف:16..PNG]] | |||
حيث أن W1 و W2 هو جزء الوزن للمركبات مع قيم Tg : Tg1 و Tg2 . تشير النتائج بشكل واضح أن الخصائص اللزجة للمواد الغير بلورية يطرأ عليها تغيرات هامة كالتحولات الصلبة من الحالة الزجاجية للحالة المطاطية. و علاوة على ذلك, تحدث هذه التغيرات نتيجة إما لارتفاع درجة الحرارة عند محتوى رطوبة ثابت أو لارتفاع في محتوى الرطوبة عند درجة حرارة ثابتة أو نتيجة اتحاد هذين الأثرين. بالنسبة للمواد الجافة الغير بلورية ,يبدأ التنقل الجزيئي للمواد الصلية بالتحسن بشكل ملحوظ بالنسبة للحالة الزجاجية المنخفضة لـ 50 تحت الـ Tg.تشير التزايدات المتماثلة في التنقل الجزيئي نتيجة التأثيرات الملدنة للماء الممتص إلى الحاجة للحفاظ على النظام اللابلوري على الأقل 50 درجة سيلسيوس تحت درجة حرارة نظام التغير الزجاجي وذلك لتجنب التغيرات في الخواص الفيزيائية و الكيميائية و الميكانيكية خلال عمر المنتج على الرف. بعض الخصائص التي من الممكن أن تتأثر تشمل : رصّ المضغوطات و هشاشة الكبسول الجيلاتيني و انهيار المساحيق الغير بلورية المجففة بالتجميد و ثباتية البروتين و ثباتية الوزن الجزيئي المنخفض و حساسية الأدوية الممتزجة مع المواد البوليمرية اللابلورية للرطوية. | |||
==امتصاص المواد الصلبة المعرضة للتصنيع للماء | |||
WATER SORPTION BY PHARMACEUTICAL SOLIDS SUBJECTED TO PROCESSING== | |||
يسمح فهم آليات امتصاص الرطوبة بواسطة المواد الصلبة المتواجدة سواء في الشكل البلوري أو الغير بلوري بتقدير مفهومي للنقاط الحرجة عندما تحدث تغيرات أساسية في الخواص الفيزيائية والكيميائية متل (RH0) الرطوبة النسبية للمواد البلورية المميه) ومع ذلك فغالبا ما تحث عمليات التصنيع للمواد الصيدلانية الصلبة (كالطحن و التجفيف بالإرذاذ و الرصّ و التجفيف بالتجميد) التغيرات الجزئية لمعظم المواد إلى أشكال طاقية أعلى. وقد ارتبطت هذه الاضطرابات الموضعية مع التفاعلية الكيميائية المتزايدة و الانحلالية المتزايدة بشكل نسبي مع الحالة البلورية المفضلة ترموديناميكيا. ويشار إلى هذه المناطق بالنقط --الساخنة- لأغلب المواد الصلبة و عندما تتواجد تترك المادة الصلبة في الحالة النشطة. | |||
يعقد عدم التجانس هذا الموجود في المواد الصلبة المصنعة دراسة ظاهرة امتصاص الرطوية لهذه المواد وذلك لأنه يجب الأخذ بالاعتبار أكثر من ميكانيكية لامتصاص الطاقة. وهذا بالأخص أمر صعب وغالبا ما يكون محبطا في الحالات التي تتواجد فيها كميات صغيرة فقط من المواد اللابلورية ويتطلب إيجاد التقنيات التجريبية لإتمام هذه التحليلات عملا مكثفا. ومع ذلك, يمكن لنسب صغيرة نسبيا من المواد اللابلورية أن تمتص كميات معتبرة من الماء داخل بنيتها وهذه المناطق تخضع لتغيرات معتبرة و تأثير متتاليا على الخواص الإجمالية للمواد بمعظمها. وهذا أمر مهم للمواد منخفضة الوزن الجزيئي التي تملك القدرة على على إعادة البلورة بسهولة نتيجة الحركة الإجمالية الكبيرة وذلك بالنسبة للمواد البوليميرية مرتفعة الوزن الجزيئي. ويظهر ذلك لمساحيق كلور الصوديوم و مساحيق ساليسات الصوديوم لمدة 15 دقيقة في المدقة والهاون. في حين لاتظهر المواد المعاد بلورتها أي تغير في مساحة السطح النوعية مع زيادة الرطوبة النسبية, تظهر مساحيق العينة انخفاض معتبر في مساحة السطح النوعية مع زيادة الرطوية النسبية. يوضح الشكل 2 صور لامتصاص الرطوبة المختلفة لعينات مساحيق كلور الصوديوم و عينات كلور الصوديوم المعاد بلورتها المطبع لمساحة السطح النوعية. في حين تمتص مساحيق المواد ماء أكثر بكثير عند رطوبات نسبية منخفضة مقارنة مع العينات المعاد بلورتها التي تمتص كميات أكير عند رطويات نسبية مرتفعة. ويعود هذا الانخفاض النسبي في سعة الامتصاص لعينة المساحيق إلى انخفاض في مساحة السطح كلما زادت الرطوبة النسبية ويعود ذلك إلى إعادة التبلور المتتالي لأسطح المواد المضطرب. ويظهر Fukuoka و Makita و Yamamura أنه يمكن بالفعل لمجموعة المواد الصيدلانية أن تصنع أشكال لابلورية و علاوة على ذلك تظهر درجة انتقال زجاجي خلال المجال من 243 كيلفن إلى 354 كيلفن. وكمثال على ذلك تظهر كل من المواد: الأسبيرين و البروجيسترون و الفينوباربيتال و سلفاديميتوكسين قيم Tg هي243 و 279 و 321 و 339 كيلفن على التوالي. | |||
بالتماثل مع الأنظمة البوليميرية اللابلورية , تظهر المواد اللابلورية منخفضة الوزن الجزيئي أيضا انخفاض في قيم الـ Tg كلما زادت محتوى الرطوبة مما يؤدي إلى شروط ملائمة لحدوث إعادة التبلور. في الواقع تمتلك المواد الصلبة اللابلورية منخفضة الوزن الجزيئي حركة جيدة جزيئة كافية تحت الـ-----. في بعض الأنظمة ذات حالات صلبة متعددة ممكنة, تؤثر فعالية الماء Tg محتوى الرطوبة على الشكل المتبلور للمادة الصلبة . لسوء الحظ, تؤدي إعادة التبلور للأنظمة الغير بلورية اللامائية منخفضة الوزن الجزيئي لتحرير كميات كافية من الماء إلى فراغ الرأس. يمتلك مقلب الرطوية هذا تأثير إضافي على الخواص الفيزيائية و الكيميائية و الميكانيكية للنظام. | |||
ولتوضيح ذلك أكثر من الناحية الكمية,اعتبر كمثال السكروز الافتراضي المناقش من قبل Ahlneck و Zografi. بافتراض أن كل الماء الممتص يشغل القسم اللابلوري للمادة فإنه سوف يندمج 0.1% من الرطوبة الكلية بشكل تقريبي مع 20% و 10% و 4% و 2% من محتوى الرطوبة من المادة اللابلورية على التوالي لكل من 0.5% و 1% و 2.5% و 5% من المادة الصلبة اللابلورية. تتراوح درجات حرارة الانتقال الزجاجي للأقسام اللابلورية لهذا النظام من 9 إلى 49 درجة سيليسوس على التوالي. وبالتالي يتوقع تغيرات هامة في خواص الحالة الصلبة عند درجة حرارة الغرفة إذا تواجد في البداية كميات صغيرة نسبيا من المادة اللابلورية (أي أقل من 1%). يوضح هذا المثال أنه حتى من أجل المواد ذات محتوى رطوية منخفض يمكن أن يحدث تغيرات مهمة في المناطق اللابلورية الموضعية للمادة الصلبة والتي يمكن أن تؤثر على خواص المواد المتأثرة بالحركة الجزيئية. | |||
يمكن إنجاز تثبيط الحوادث الناتجة من زبادة الحركة الجزيئية العائدة إلى زيادة امتصاص الرطوبة و الانخفاض المتتالي في الـTg عن طريق صياغة هذه المواد مع مواد لابلورية مرتفعة الـTg. التأثير الصافي هو زيادة التفاعل الجزيئي و رفع نظام الـ Tg إلى مستوى تعود فيه الحركة الجزيئية مرة أخرى لتنخفض بمافيه الكفاية (لزوجة عالية) بحيث أن التغيرات الغير مرغوبة في الخواص لايمكن أن تحدث. | |||
يمكن لف إعادة التبلور للأنظمة اللابلورية منخفضة الوزن الجزيئي بواسطة أثر التغيرات البنيوية على المواد. على سبيل المثال, ينتج a-lactose اللاكتوز أحادي التميه المجفف بالرذاذ بشكل نموذجي مادة لا بلورية بشكل تام كما حددت بواسطة انعراج الأشعة السينية. و مع ذلك, بخضع اللاكتوز لدوران متعلق ب المُصاوِغُ الكَربُونِيلِيّ في المحلول مما يسبب تغير في البنية الأساسية للجزيء. الأثر على هذا التغير البنيوي على امتصاص و موازنة الماء على اللاكتوز اللابلوري هو أثر ذو معنى. سوف ينتج كما هو متوقع زيادة في محتوى الرطوبة على شكل كبت في درجة حرارة الانتقال الزجاجي إلى نقطة حيث يحدث فيها التبلور الآني. و مع ذلك, المواد الناتجة هي غير منتظمة بحيث يوجد شكلين مختلفين من اللاكتوز أحده هو اللامائي في الحالة اللابلورية. علاوة على ذلك, يمكن أن يخضع الشكل اللامائي b-anhydrat اللابلوري عند ارتفاع الرطوبة إلى تغير بنيوي في الحالة الصلية و ينتج a-monohydrate أحادي التميه. يحتاج تقييم البيانات المحسوبة أن يستكمل في سياق الوصف الدقيق للأشكال الصلبة الممكنة. | |||
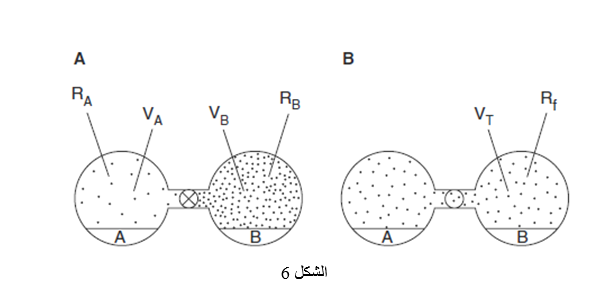
==نقل الماء بين المكونات الصلية عبر فراغ الرأس | |||
TRANSFER OF WATER BETWEEN SOLID COMPONENTS VIA THE HEADSPACE== | |||
الجمع بين المواد الصلبة التي تم معايرتها مسبقا عند درجات رطوبة نسبية مختلفة ينتج على شكل نظام غير مستقر ترموديناميكيا بسبب وجود ميل لتوزع الرطوبة في النظام بحيث يبلغ رطوبة نسبية مفردة في فراغ الرأس. كما هو موضح في الشكل 6, فإن الرطوية ستلتفظ إلى فراغ الرأس من المكونات المتوازنة من البداية عند درجات رطوبة نسبية عالية و ستمتص إلى المكونات المتوازنة من البداية عند درجات رطوبة نسبية منخفضة. تستمر هذه العملية إلى أن يتم توازن كلا المواد الصلبة عند درجة الرطوبة النسبية النهائية. يمكن للشخص التنبؤ مسبقا بالرطوبة النسبية النهائية عن طريق نموذج انتقال التقاط و التفاظ الرطوبة (SDMT) model إذا كان يملك خط تساوي الحرارة لامتصاص الرطوبة لكل واحد من المكونات الصلبة من محتوى الرطوبة البدائية | |||
[[ملف:6..PNG]] | |||
التمثيل الترسيمي لانتقال الرطوبة بين المكونات الصلبة A و B على التوالي. | |||
(A) فراغ الراس المعزولة عن بعضها البعض و (B) فراغ الرأس السامح بالتوازن. | |||
RA وRB هم الرطوبات النسبية البدئية فوق A و B على التوالي. | |||
VA وVB هما حجوم فراغات الرأس فوق A و B على التوالي. | |||
Rfو-VT هم الرطوبة النسبية النهائية و حجم فراغ الرأس فوق A وB على التوالي. | |||
محتوى الرطوبة والأوزان الصلبة و حجم فراغ الرأس و درجة الحرارة. ويمكن تقييم محتويات الرطوبة النهائية لكل من المادة الصلبة بسهولة من خط تساوي الحرارة الخاص بالمادة الصلبة. | |||
يملك نموذج SDMT فائدة عملية في المساعدة في التحسين الرشيد لمحتويات الرطوبة البدائية لمكونات النظام الفردية للحصول على الرطوبة النسبية النهائية المطلوبة. تتضمن التطبيقات العملية حتى الآن ضبط تركيبة الـLODS البدائية قبل ملء المحافظ لتجنب هشاشة المحافظ الجيلاتينية باستخدام تركيبة محتوى الرطوبة المناسبة و مقدار التجفيف للحفاظ على الرطوبة النهائية داخل الوعاء تحت القيمة المحددة واختيار تصميم منشقة للبودرة الجافة مناسب و شروط للتعبئة من أجل ثباتية مثلى. | |||
==الخاتمة== | |||
تتواجد الرطوبة في كافة الأدوية الصيدلانية الصلبة و الأشكال الجرعية و معظم تقنيات المعالجة. فهم تواجد ثمالة الماء و حالته و الأسلوب التي تؤثر فيها على خواص المواد المفردة و خواص الخلائط و في النهاية على أداء المنتج النهائي وكماله كلها ضرورية لتطوير العلماء لفهم أفضل لدور الماء في النظام الخصوصي. وكأهمية بصورة خاصة حرائك قبط وخسران الرطوبة و قيم توازن القبط كتوابع للرطوبة النسبية سواء كانت ثمالة الماء خارجية أو امتصت إلى الجسم الصلب و درجة ارتباط الماء بالجسم الصلب و ميول الماء لإعادة التوزع في النظام المكون من أكثر من مادة صلبة. يمكن توجيه تطبيقات هذه الأفكار الأساسية لتطوير الإنتاج في فهم دور الرطوبة في التأثير على الخواص الفيزيوكيميائية للمواد الصلبة على الرغم من أن تفاعلات الماء مع المادة الصلبة يمكن أن تكون معقدة كثيرا في الأنظمة الصيدلانية. | |||
[[تصنيف:صيدلة]] | |||
[[تصنيف:أدوية]] | |||
[[تصنيف:موسوعة التكنولوجيا الصيدلية]] | |||
المراجعة الحالية بتاريخ 19:43، 19 ديسمبر 2015
امتزاز الماء للأدوية و الأشكال الصيدلانية Water Sorption of Drugs and Dosage Forms مقدمة INTRODUCTION : تعتمد الخواص الكيميائية والفيزيائية والميكانيكية للمستحضرات الدوائية والأشكال الصيدلانية بشكل حرج على وجود الرطوبة. يستطيع العلماء الصيدلانيون ذكر العديد من الأمثلة على الخواص المرغوبة والغير مرغوبة التي تنتج من مستويات متنوعة للرطوبة المرتبطة مع مادة صلبة محددة أو تركيبة لمزيج من المواد الصلبة.
التدفق والرص والتكتل والتفتت والانحلالية والقساوة والثبات الكيميائي هي فقط بعض الخواص التي تتأثر بوجود الرطوبة . بسبب تواجد كتلة الماء على شكل سائل أو كبخار عند درجة رطوبة نسبية بشكل فعلي في جميع مراحل تصنيع المواد الصلبة
(مكونات فعالة و سواغات) وتخزينها ومعالجتها إلى تركيبة وتعبئة المنتج النهائي ولذلك من الضروري الفهم الأساسي لدور الماء في التأثير على خواص المواد الصلبة والعكس بالعكس.
على الرغم من أن خواص المواد الصلبة المنفردة وأداء الأشكال الصيدلانية الصلبة يعتمد على الرطوبة فإن وصف تأثر الماء التحتي بالمواد الصلبة غالبا ما يكون غير واضحا. وكمثال على ذلك فإن العديد من المواد الصلبة توصف على أنها محبة للرطوبة بدون الإشارة فيما وكم هذا يكون مرتبطا بمعدل أو كمية امتصاص الرطوبة كتابع للرطوبة النسبية أو درجة الحرارة. ولتوضيح هذا الغموض اعتبر أن المواد البلورية غير القابلة للتميه والمنحلة في الماء ككلوريد الصوديوم تمتص كميات قليلة جدا من الرطوبة ( أقل من 0,1 %) تحت رطوبتها النسبية الحرجة حيث أن الصلبة منها قادرة في الواقع على الانحلال في تلك الرطوبة الممتزة. من جهة أخرى تستخدم بعض السواغات النموذجية قي الأشكال الصيدلانية الصلبة كالنشاء والسيللوز والمحافظ الهلامية تمتص كميات معتبرة من الرطوبة (من 20-50%) وعلى الرغم من ذلك فهذه المواد لا تنحل في الماء بل يطرأ عليها عند رطوبة نسبية عالية تغييرات ذات أهمية تتعلق بالشكل (الانتباج). تعتمد سرعة امتصاص المواد للرطوبة على الرطوبة النسبية للوسط المحيط ومحتوى المادة الصلبة من الرطوبة المعتمد على الزمن. من أجل الحالات التي تكون فيها الرطوبة النسبية للوسط المحيط مختلفة بشكل كبير عن الرطوبة التي كان فيها السواغ( كالجيلاتين) سابقا في حالة توازن فإن معدل امتصاص أو فقدان الرطوبة الأولية سيكون ذو أهمية ولكنه سوف سيتناهى إلى الصفر مع مرور الزمن. ومن جهة أخرى فإن للمواد البلورية غير القابلة للتميه والمنحلة في الماء ( ككلوريد الصوديوم) معدل امتصاص أو فقدان للرطوبة منخفض جدا سوف يتناقص إلى الصفر إذا بقيت الرطوبة النسبية للوسط المحيط تحت درجة الرطوبة النسبية الحرجة. ولكن إذا كانت الرطوبة النسبية فوق الدرجة الحرجة فإن معدل امتصاص الرطوبة سيكون كبيرا ومستمرا نسبيا حتى تمام انحلال المادة الصلبة، تحدث بشكل واضح للعينات المختلفة آليات متعددة لامتصاص أو امتزاز الماء. على ضوء ذلك, فإن وصف كلوريد الصوديوم أو النشاء كمادة محبة للماء يعطي فهما قليلا للتأثيرات الحاصلة بين الماء والمادة الصلبة التي قد تؤثر على صفاته الكيميائية والفيزيائية. توضح هذه الأمثلة الحاجة إلى فهم الآليات الدفينة لامتصاص الأجسام الصلبة للرطوبة. لذا في هذا الخصوص تقدم عنونة الأسئلة التالية قواعد لدراسة آليات متعددة للتأثيرات بين الماء والمادة الصلبة:
- ما هي كمية الماء وما هي فعالية الماء المتوافقة مدانية للضغط النسبي أو النسبة المئوية للرطوبة النسبية؟
- ما هي حركية امتصاص أو فقدان الرطوبة وما هو ثابت السرعة أو التغير خلال الزمن؟
- أين يقع الماء (هل هو ممتز على السطح الخارجي للبلورة أو ممتص داخل البلورة كماء إماهة محدد أوغير محدد أو ممتص داخل مناطق لابلورية أو متكثف ضن المسامات الخ؟
- ما هي حالة الرطوبة المرتبطة مع الجسم الصلب كتلة الماء أو ماء الإماهة أو الماء الممتص فيزيائيا إلخ؟
- ما هو شكل الجسم الصلب المتواجد (حجم الجسيم وشكله والأصناف المتعددة الأشكال ودرجة التبلور وحالة الإماهة ) وهل هو ثابت ترموديناميكيا ضمن درجة حرارة ونطاق رطوبة نسبية وبأي شكل يتوقع وجوده ؟
إن الغرض من هذا المقال إلقاء الضوء على الآليات المختلفة التي يستطيع الماء بواسطتها التفاعل مع المواد الصلبة، المنهجيات الحالية التي يمكن استخدامها للحصول على المعطيات الضرورية ومن ثم مناقشة امتصاص المواد الصلبة البلورية القابلة للتميه وغير القابلة للتميه للرطوبة تحت وفوق درجة رطوبتها النسبية الحرجة وذلك للمواد الصلبة اللابلورية والمواد المصنعة صيدلانيا. سنناقش في النهاية انتقال الرطوبة من مادة إلى أخرى.
خط تساوي درجة الحرارة لامتصاص الماء THE WATER SORPTION ISOTHERM:
خط تساوي الحرارة لإمتزاز أو امتصاص الماء هو النمط الأساسي في توضيح العلاقة بين بخار الماء الممتص و الجسم الصلب. يصف هذا الخط العلاقة بين الكمية المتوازنة من بخار الماء الممتص على الجسم الصلب ( يعبر عنه عادة ككمية بواحدة وزن أو واحدة مساحة الجسم الصلب) وبين الكمية التيرموديناميكية ، فعالية الماء water activity (αw)، وذلك عند درجة حرارة ثابتة وضغط ثابت. عند التوازن يجب أن يكون الكمون الكيميائي للماء الممتص على الجسم الصلب مساويا للكمون الكيمائية للماء في طور البخار. تتعلق فعالية الماء في طور البخار بالكمون الكيمائية من خلال العلاقة
حيث أن µ هي الكمون الكيمائي للماء في الجملة عند التوازن و µ˚ هي الكمون الكيمائي المعياري للماء عند درجة حرارة مرجعية معينة وضغط معين و R هي ثابت الغازات و T هي درجة الحرارة المطلقة. عرَف لويس الفعالية النسبية لأي مادة نقية أو مركب ( كالماء) كنسبة الافتلات
حيث هي افتلات الماء في الجملة عند التوازن وهي افتلات الماء النقي عند درجة حرارة معيارية وضغط معياري، من أجل غايات عملية فإنه يمكن تقريب انفلات (قابليته للارتشاح) بخار الماء بواسطة ضغط بخار الماء في الجملة. هذا الافتراض يكون صحيحا طالما أن بخار الماء يسلك سلوك الغاز المثالي. من أجل مجال ضغط بخار الماء الذي له علاقة بالجملة الصيدلانية عند درجة حرارة أقل من 50 درجة مئوية يكون التقريب ممتاز ( أصغر من 0.2 % كخطأ نسبي) لذا يستعمل الضغط النسبي لبخار الماء عادة كتقدير لفعالية الماء النسبية في الجملة.
حيث أن هو ضغط بخار الماء في الجملة وهو ضغط بخار الماء النقي عند درجة الحرارة المدروسة. تعرف الرطوبة النسبية على أنها ضغط نسبي معبر عنه كنسبة مئوية:
يُكتسب قسم الامتصاص لخط تساوي درجة الحرارة تجريبيا من خلال قياس الكمية المتوازنة من الماء الممتص على الجسم الصلب عند الضغط النسبي المعلوم، ابتداء بكتلة معلومة لجسم صلب جاف حتما وبعد ذلك تزايد تدريجي للضغط النسبي في الجملة. تجفيف عينة الجسم الصلب بتعريضها للحرارة ربما باستخدام الخلاء لتسهيل إزالة بخار الماء الممتص غالبا ما يكون ضروريا. ولكن يجب أن نكون مدركين لتأثير هذه الشروط على الثباتية الفيزيائية والكيميائية للجسم الصلب. يكتسب قسم الامتزاز لخط تساوي درجة حرارة للضغط النسبي من خلال تناقص تدريجي للضغط النسبي في الجملة من ضغط نسبي لوحدة تقريبية و أيضا مراقبة الكمية المتوازنة من الرطوبة الممتصة عند كل ضغط نسبي. تذكر أن خط تساوي درجة الحرارة للرطوبة الممتصة هو قياس متوازن لتفاعل الماء مع الجسم الصلب. إن المعلومات المتعلقة بحركية امتصاص الرطوبة نظريا ليست مستمدة بشكل واضح من التجربة. هذا التفريق هام جدا وسيتم الخوض فيه بعمق أكثر لاحقا. يمكن أن يزود تولد خط تساوي درجة الحرارة لامتزاز أو امتصاص الماء لجسم صلب منفرد بنظرة هامة إلى طبيعة التفاعل بين الماء والجسم الصلب. وأيضا مميزات السطح لجسم صلب. هذه المعلومات مستمدة بسهولة من كمية الرطوبة الممتصة عند رطوبة نسبية أدنى بالمقارنة مع مساحة السطح النوعية للعينة. وتستمد المعلومات أيضا من الشكل العام لخط تساوي درجة الحرارة ومن ما إذا كان امتصاص الماء عملية عكوسة تماما أو لا ( إذا كان التلاكؤ ملاحظا بين الامتزاز والامتصاص ) وتستمد أيضا من شكل عقدة التلاكؤ إذا كانت موجودة . ويمكن للمرء من خلال المعلومات المذكورة سابقا أن يستمد دلالة فيما يتعلق بآلية امتصاص الرطوبة للمواد ذات الأهمية على سبيل المثال المادة التي تبدي امتصاصا عند رطوبة نسبية أدنى بكميات أكبر بكثير من التي يمكن توقعها اعتمادا على مساحة السطح النوعية للعينة وتبدي تلاكؤاَ خلال المجال الكامل لدرجات الرطوبة النسبية هي غالبا ما تمتص الماء ضمن بنيتها الداخلية. ومن جهة أخرى فإن إظهار المادة لعقدة تلاكؤ مغلقة خلال مجال رطوبة نسبية أعلى بينما تبدي امتصاصا للرطوبة خلال مجال رطوبة نسبية أدنى مشابه لما يمكن توقعه اعتمادا على مساحة سطحها النوعية هي على الأرجح أن تكون ذات طبيعة مسامية تماما وغالبا ما تمتص الماء بواسطة تكاثف شعري خلال مجال رطوبة نسيبة أعلى.
نماذج لوصف امتزاز البخار MODELS DESCRIBING VAPOR ADSORPTION
Brunauer, Emmett, and Teller Equation
تم وضع النموذج الذي يشار إليه في الأدب بشكل شائع والذي يصف امتزاز البخار على السطوح الصلبة في الشهر الرابع من عام ألف وتسعمئة وثمان وثلاثون على يد العلماء , and Teller , Emmett , Brunauer تم اشتقاق النموذج الذي يدعى BET model بشكل أساسي باستخدام براهين حركية بأسلوب مشابه كثيرا لتلك البراهين المستخدمة من قبل Langmuir ومنذ ذلك الوقت تم أيضا اشتقاق النموذج BET باستخدام تقنيات إحصائية. يفترض النموذج BET أن جزيئات البخار تسلك سلوك غاز مثالي موجود في حالة توازن مع مادة صلبة مكونة من مواقع متشابهة ومتجانسة وممتزة. يفترض أن يكون الجزيء الأول الممتز على موقع امتزاز المادة الصلبة مرتبطا بينما يفترض أن تمتلك الجزيئات الممتزة خلف الطبقة الأولى خصائص معظم السائل. من ناحية أخرى يفترض أن يحدث الامتزاز كي لا تتفاعل الجزيئات الممتزة لاحقا. الشكل الخطي لمعادلة BET هي:
حيث أن W : هي كتلة البخار الممتز في كل غرام من المادة الصلبة عند ضعط نسبي محدد. p/p0 ; Wm : هي الكمية النظرية للبخار الممتز عند امتلاك كل موقع امتزاز لجزيء بخار واحد ممتز عليه و
حيث H1 هي حرارة امتزاز أول جزيء بخار ممتز على الموقع HL هي حرارة التكثيف لمعظم الحجم المكثف R هي ثابت الغازات العام و T هي درجة الحرارة المطلقة و K هو ثابت يفترض عادة أن يكون مقاربا للواحد. يمكن الحصول بسهولة على ثابتي BET من شكل النموذج الخطي لمعادلة BET المعطاة في المعادلة رقم 5. يعطينا تعيين الكمية 1/[W(P0/P _ 1)] مقابل P/P0 ميلا مساويا ل (Cb _ 1)/WmCb و تقاطعه مع محور العينات 1/WmCb تعطي المعالجة الجبرية
بشكل عام تناسب معادلة النموذج BET بيانات الامتزاز بشكل جيد جدا خلال مجال ضغط نسبي يتراوح بين 0.05 و 0.35 ولكن يتوقع أن يتم امتزاز أكثر عند ضغط نسبي أعلى من الملاحظ في التجربة. وهذا متناسق مع افتراض تم وضعه من اشتقاق النموذج BET أن عددا لانهائيا من الطبقات تمتز عند ضغط نسبي مقارب للواحد. تتم تطبيقات المعادلة على نتائج امتزاز غاز لاقطبي بشكل متكرر للحصول على تقدير لمساحة سطح محددة للعينات الصلبة.
بافتراض مساحة مقطع عرضي لجزيئات ممتزة نستطيع استخدام BET لحساب مساحة السطح المحددة من خلال العلاقة التالية:
حيث أن S مساحة السطح المحددة بالمتر المربع على غرام . Wmهي كتلة التكثيف الممتزة على تغطية مكونة من طبقة واحدة X هي مساحة مقطع عرضي لجزيئات التكثيف الممتزة (يفترض أن تكون 19.5 أنغستروم مربع لغاز الكريبتون و 16.2 أنغستروم مربع لغاز النتروجين و 12.5 للماء) Nav هي عدد افوغادرو و∑ هي الكتلة الجزيئية للمادة المتكثفة وM هي كتلة العينة. بشكل واضح فإن حساب مساحات السطوح من بيانات امتصاص الرطوبة التي لا تؤدي إلى تغطية مكونة من طبقة واحدة عند Wm( إما تغطية غير كاملة ( انظر إلى الأسفل قسم * امتصاص الماء على المواد اللامائية *) أو امتصاص داخل المادة الصلبة ( انظر إلى قسم * تفسير مساحات السطوح المحددة المحسوبة من دراسات الماء الممتص )) سوف ينتج عنها قيم غير صحيحة ليس لها أي معنى فيزيائي . ولذلك فإن مقارنة مساحة السطح المقاسة بامتزاز غاز لاقطبي مع تلك المحسوبة من خط تساوي امتصاص الرطوبة يمكن أن تعطينا نظرة على التفاعلات الأساسية بين الماء والمادة الصلبة. وسيتم اكتشاف هذا بعمق لاحقا.
Guggenheim and deBoer Equation
تم القيام بالعديد من المحاولات لتعديل نظرية الامتزاز BET منذ اشتقاقها الأصلي. ولكن بساطة هذه النظرية و قدرتها على احتواء بيانات الامتصاص بشكل جيد عند ضغط نسبي منخفض جعلت منها الخيار النموذجي لتقدير مساحات السطوح لامتزاز الغاز اللاقطبي. ظهر العديد من تعديلات النموذج BET كإضافة عامل متغير مناسب على الأقل للمعادلة لتحليل البيانات خلال كامل مجال الضغط النسبي. هذا يجعل تجهيزات الكومبيوتر ضروية بسبب توفر عاملين متغيرين قابلين للقياس فقط هماW و p/p0. من وجهة نظرنموذجية فإن عوامل التغيير الإضافية لمضمون فيزيائي غير معروف أو غير محدد والتي ظهرت من مثل هكذا أساليب غالبا ما تكون مانعة لاستخدام نماذج عوامل تغيير متعددة بسبب الصعوبات المتكررة في تفسير النتائج. ضمن هذا الاعتبار فإن تعديلا واحدا فقط للنموذج BET والذي ظهر أنه تجاوز مجال الضغط النسبي الذي يحوي بيانات امتزاز البخار سيتم اعتباره هنا. تم اعتبار هذا الامتداد للنموذج BET المشتق بشكل مستقل من قبل العالمين Guggenheim و deBoer من أجل حالة وسطية للبخار بين الجزيء الأول المرتبط بقوة الممتز على موقع الامتزاز و بين جزيئات التكثيف الممتزة ضمن ضغط نسبي عالي جدا. يمكن اعتبار أن الجزيئات الممتزة في المجال الوسطي تتفاعل مع المادة الصلبة ولكن هذا التفاعل يُفترض أن يكون أقل من تفاعل الجزيء الأول الممتص على موقع الامتزاز. وبشكل واضح فإن إضافة ( حالة ثالثة) للتفاعل هي تقريبية. في جميع الاحتمالات هناك تتابع لحالات التفاعل ولكن من وجهة نظر حسابية فإن تمدد ثلاث حالات أو أكثر غير مُلاحظ. تعطى معادلة تفاعلات الحالات الثلاثة من خلال العلاقة:
حيث P و P0 وHL وW و Wm هي مطابقة لعوامل التغيير المتسخدمة في معادلة النموذج BET
و
حيث B هي ثابت و T هي حرارة البخار الممتز في الطبقة الوسطى. يُعرَف الثابت CG ك :
حيث ان D ثابت و H1 هي حرارة الامتزاز لأول جزيء ممتز على الموقع وHm هي حرارة الامتزاز للجزيء المرتبط وسطيا.
امتزاز بخار الماء بواسطة المواد الصلبة اللابلورية Water Vapor Absorption by Amorphous Solids
قورنت عملية تفاعل بخار الماء مع المواد الصلبة اللابلورية مع عملية إنتاج محلول صلب الذي فيه ينحل الماء في القالب الصلب. ومع امتصاص كمية أكبر من الماء فإن الخواص الأساسية للقالب الصلب (على سبيل المثال اللزوجة) يمكن ان يطرأ عليها تغير معتبر والذي يمكن أن يسبب تغيرات مرئية في الخواص الفيزيائية (على سبيل المثال الانهيار وإعادة البلورة ). وسيتم مناقشة ذلك بتفصيل أكثر لاحقا. على الرغم من أن بخار الماء يمتص ضمن المواد الصلبة اللابلورية وليس يمتز على السطح بوضوح فإنه وجد أن خط تساوي الامتصاص يمكن أن توافقه معادلة النموذج BET حتى p/p0 يقارب ال 0.40 مع امتزاز البخار وخلال المجال الكامل ل p/p0 باستخدام امتداده. ولأن ذلك تم الإعلان عنه أولا من قبل العالم Anderson لتكون حالة امتصاص الماء ( المعادلة 10 )عند تطبيقها على امتصاص بخار الماء غالبا ما تدعى معادلة GAB للعلماء Guggenheim و Anderson و deBoer .من أجل المنهج النظري لاشتقاق المعادلة الأصلية الذي لا يترجم بشكل مباشر إلى عملية الامتصاص التي تتضمن انحلالية الماء في الأجسام الصلبة اللابلورية فإن مدلول ملائمته للمعادلة GAB محدود قليلا. غير أن المعادلة GAB معادلة مفيدة لأنها تسمح للشخص أن يصف كامل خط التساوي وأن يسحب بعض عوامل التغير المفيدة( سيتم شرحها لاحقا ).
بما أن بخار الماء ينحل ضمن المادة الصلبة خلال الامتصاص فإنه تم اشتقاق نماذج عديدة اعتمادا على نظرية المحل تفرض أن السوربات تدخل ضمن المادة الصلبة كمحلول صلب وتم استخدام هذه النماذج لوصف امتصاص الماء على البوليميرات.
مثل Flory Huggins,[20] Hallwood-Horrobin[21] )- ) فقد طورا مؤخرا نموذج معتمد على المحلول يفسر التأثير اللين للماء على البولمير الذي ظهر انه يصف كامل خط تساوي امتصاص الرطوبة للبوليمير. بينما اعتمدت نظريات الامتصاص و العديد من التعديلات على نموذج الامتزاز BET على أساسات فيزيائية كيميائية ذات معنى فإنه مازال يتطلب عملا إضافيا من أجل تفسير التقنية الجزيئية امتصاص ضمني للرطوبة في النظام البوليمري. من هذا المنظور فان نماذج أخرى معتمدة على مفاهيم مختلفة نظريا كليا لم يتم اعتبارها في هذه المقالة. من أجل مراجع أخرى فإنه يتم توجيه القارئ إلى مراجع مطبوعة متعددة و ممتازة للعديد من نظريات الامتصاص التي تم اقتراحها.
التكثيف الشعري : Capillary Condensation
يختلف امتصاص البخار على المادة الصلبة المسامية عن امتصاصه على سطوح المواد المسطحة في أن البخار ( في هذه الحالة , الماء ) سوف يتكثف إلى سائل ذو بنية مسامية عند ضغط البخار pr أدنى من ضغط البخار p0 الذي يحدث عندما يكون التكيثف عند سطوح مسطحة. يعود هذا بشكل عام إلى قوى التجاذب المتزايدة بين الجزيئات الممتزة و التي تظهر كأنها سطوح منحنية بقوة كمسام أو أنبوب شعري. يشار إلى هذه الظاهرة بالتكثيف الشعري وتوصف بمعادلة Kelvin
حيث أن هي التوتر السطحي للطبقة الرقيقة الممتزة ( يفترض أنه مساوي للتوتر السطحي على معظم السائل) و Vm هو الحجم المولي للسائل و r هي نصف قطر المسام و R هي ثابت الغازات العام و T هي درجة الحرارة. أظهرت معادلة Kelvin أنها قابلة للتطبيق على المسام ذات نصف قطر صغير ك 5 نانومتر لامتصاص الماء على الميكا. كما ذكر في قسم ( خط تساوي امتصاص الماء) فإن التكثيف الشعري سوف يظهر على شكل حلقة تلاكؤ مغلقة في خط تساوي الامتصاص والامتزاز للمادة المسامية. يظهر حساب pr/p0 أن التكثيف متوقع عند ضغط نسبي مساوي ل 0.998, 0.989, 0.898) 0.340 ,) وذلك لسم نصف قطره مساوي ل (1000 و 100 و 10 و1) نانومتر على التوالي وذلك بافتراض قيمة توتر سطحي للماء مساوي ل 72.8 ergs/cm2وكثافة مساوية ل 0.998 g/cm3 عند درجة حرارة 293K ( قد أظهر هذا الافتراض من أجل استعمالات الحساب أن كثافة الماء هي أخفض في السم من معظم الحجم). في هذا الصدد يظهر بشكل واضح أن الحاجة إلى التكثيف الشعري تؤخذ بعين الاعتبار فقط من أجل أبعاد صغيرة جدا للسم. بتعابير عملية فإنه يجب أن يهتم الإنسان بفهم تقنيات الماء من أجل مساحيق صيدلانية مسامية دقيقة والتي تبدي مساحات سطح نوعية كبيرة نسبيا ( مثال < 100m2/g) التي حددت من خلال دراسات على امتزاز غاز غير قطبي .
المنهجيات : METHODOLOGY
التحكم بالرطوبة النسبية Control of Relative Humidity
إن الحفاظ على بيئات ذات رطوبة نسبية ثابتة أساسي من أجل دراسة التفاعلات بين الصلب والماء. هناك أربع تقنيات في الأصل توظف كثيرا من أجل الحفاظ على رطوبة نسبية ثابتة:
1-محاليل ضمامية 2-تعديلات حرارية من أجل محاليل مائية 3-تحكم بالضغط الكلي فوق الصلب 4-مزج بين تيارت هوائية رطبة وجافة تحقق المحاليل الملحية المشبعة و محالي
ل حمض الكبريت رطوبة نسبية من خلال إنقاص ضغط البخار فوق المحاليل المائية ( تأثير ضمامي). تحافظ المحاليل الملحية المشبعة عند درجة حرارة متحكم بها على رطوبة نسبية ثابتة طالما أن الملح الفائض ومعظم المحلول متواجدون.عند إضافة الماء أو إزالة الماء من المحلول فإن الرطوبة السطحية إما أن تتكثف أو تتبخر(حسب ما يناسبه),مع ذوبان متتالي أو ترسيب للملح للحفاظ على توازن ضغط البخار. لأن درجة انخفاض ضغط البخار تعتمد على عدد الأنواع في المحلول و أكثر من ذلك بما إن الذوبانية لمعظم الأملاح بشكل ما تعتمد على درجة الحرارة فإن الرطوبة النسبية المتولدة أيضا تعتمد على درجة الحرارة.من الآن يمكن أن ينتج عن استخدام نفس الملح في درجات حرارة مختلفة رطوبات نسبية مختلفة. يمكن أن نعود إلى المراجع من أجل محاليل ملحية مشبعة معينة التي ينتج عنها رطوبات نسبية محددة كتابع لدرجة الحرارة. إنه من الأساسي أن يكون التشبع محققا سابقا للبدء بالتجربة لأن الرطوبة النسبية تعتمد على عدد الأنواع المنحلة. في هذا الصدد فإنه ينصح بتحضير المحلول الملحي قبل بداية دراسة الامتصاص. تستخدم محاليل حمض الكبريت بتراكيز مختلفة أيضا من أجل الحصول على رطوبات نسبية. إن إضافة أو إزالة الماء من المحلول بالتفاظ أو امتصاص الماء على الصلب يعدل من تركيز حمض الكبريت (والماء) في المحلول وبهكذا يغير الرطوبة النسبية لسطح السائل. تستخدم هذه التقنية عمليا للتحكم بالرطوبة النسبية على السطح بشكل أكبر عند امتصاص كميات صغيرة من الماء أو التفاظها من الصلب.
يمكن أيضا استخدام تعديلات درجة الحرارة للمحاليل المائية للحفاظ على رطوبة نسبية ثابتة في الفراغ. تحافظ هذه التقنية على ان يكون الجسم الصلب في درجة حرارة واحدة والمحلول المائي المرتبط بالنظام في درجة حرارة اخرى. بسبب الاعتماد القوي لضغط البخار على درجة الحرارة فإنه من المطلوب أن يكون لدينا تحكم شديد بدرجة الحرارة للمحلول المائي و الجسم الصلب للحفاظ من خلال هذه التقنية على رطوبة نسبية ثابتة في جوار الجسم الصلب. كما يمكن أيضا استخدام التحكم بضغط البخار في الخلاء فوق الجسم الصلب من أجل الحفاظ على رطوبة نسبية فوق الصلب. كما هو موضح في المعادلة (4) ترتبط الرطوبة النسبية ارتباطا مباشرا بالضغط الجزئي للماء في الطور البخاري. لاستخدام هذه التقنية للتحكم بالرطوبة النسبية فإنه يجب أن يفرغ الخلاء فوق العينة تفريغا كاملا قبل التحليل .يمكن اعتبار بخار الماء النقي في الطور البخاري . بسبب تواجد بخار الماء فقط فإن الضغط المقاس فوق الجملة هو مرتبط بشكل مباشر مع الرطوبة النسبية فوق العينة.
كما يمكن استخدام مزج هواء بخار الماء الجاف و المشبع في أبعاد معروفة من أجل توليد رطوبة نسبية ثابتة. إن التحكم بمعدلات التدفق و بمحتوى الهواء الجاف والمشبع من بخار الماء هو أساسي من اجل انتاج رطوبة نسبية دقيقة وقابلة لإعادة الإنتاج.
قياس الرطوبة النسيبة: Measurement of Relative Humidity
يعتمد قياس الرطوبة النسبية على استخدام الجملة. الأنظمة التي تستخدم الخلاء تفرغ عادة قبل دخول بخار الماء. من أجل الحالات التي لا تحدث فيها تفاعلات تشكل البخار يمكن استخدام قياس الضغط الكلي في النظام كوسيلة قياس ضغط بخار الماء. تتطلب الأنظمة التي لم يفرغ فيها الهواء مقياس معين لضغط بخار الماء . (يجب أخذ الاحتياط في نموذج الأانظمة الوارد ذكره سابقا للتأكد من أن مصدر الرطوبة النسبية قريب بشكل تقريبي من الجسم الصلب بما أن انتشار بخار الماء في الهواء إلى الجسم الصلب مطلوب من اجل الحفاظ على رطوبة نسبية ثابتة في المحيط المجاور مباشرة للجسم الصلب). يتوفر تجاريا مجموعة واسعة من اجهزة قياس الضغط مع اختلاف في الدقة والصحة و الكلفة.
قياس الرطوبة النسبية الحرجة : Measurement of the Critical Relative Humidity, RH0
يمكن تحديد الرطوبة النسبية التي يتميع عندها الجسم الصلب من خلال ثلاثة طرق: أولا: بشكل مباشر عن طريق قياس الرطوبة لنسبية فوق المحلول المشبع للمادة
ثانيا :من خلال تحديد الرطوبة النسبية التي تكون عندما يترافق حدوث امتصاص لرطوبة معينة مع الانحلالية
ثالثا: بشكل غير مباشر عن طريق قياس الحالة المستقرة لمعدل امتصاص الرطوبة عند رطوبة نسبية فوق الرطوبة النسبية الحرجة ومن ثم استقراء للرطوبة النسبية التي يكون عندها معدل امتصاص الرطوبة مساويا للصفر.
على الرغم من أنه يمكن استخدام تقنيات أخرى من أجل قياس الرطوبة النسبية فوق المحلول المشبع فإنه يمكن القيام بعملية بسيطة نسبيا عن طريق تخلية الفراغ ( إزاحة الهواء عن طريق انتشار الطور البخاري) ومن ثم فصل مضخات الخلاء و الحفاظ على المحلول المشبع عند درجة حرارة ثابتة من أجل قياس ضغط بخار الماء. يمكن تحويل ضغط بخار الماء إلى رطوبة نسبية عن طريق من خلال التقسيم على p0 وهو ضغط بخار الماء فوق الماء النقي عند درجة الحرارة المطلوبة.
مقياس امتصاص الرطوبة (حرائك الميوعية) (Kinetics of Deliquescence) Measurement of Moisture Uptake
يتطلب معدل امتصاص الرطوبة فوق الرطوبة النسبية الحرجة المحافظة وقياس لمجال من الرطوبة النسبية و القابلية لقياس محتوى الجسم الصلب من الرطوبة خلال مرور الوقت. يمكن تقليل انتشار الغاز خلال الفراغ باستخدام نظام الخلاء و بالتالي نستطيع الحفاظ على رطوبة نسبية ثابتة في المحيط المجاور للعينة. أيضا من أجل تقييم أكثر موثوقية للحالة الثابتة لمعدل امتصاص الرطوبة يحصل عندما يكون كامل الجسم الصلب سليما و تكون طبقة امتصاص الرطوبة رقيقة(على الأرجح مشبعة تقريبا)’ فمن المستحسن تحديد معدل امتصاص الرطوبة في فترات زمنية مبكرة. وفي هذا الصدد, إمكانية مشاهدة الجسم الصلب خلال التجربة مفيدة أيضا لإثبات الحفاظ على السلامة و بقاء الفائض من الجسم الصلب. قياس توازن امتصاص الرطوبة. Moisture Sorption Measurement of Equilibrium
يمكن أن يتم توليد خط تساوي الحرارة لامتصاص و امتزاز الماء في بيئة رطوبة نسبية مراقبة إما حسب الثقل أو حسب الحجم. تتطلب طريقة الثقل النوعي : 1-وزن العينة الجافة 2-درجة حرارة ثابتة للعينة 3-الحفاظ على الرطوبة النسبية الثابتة للعينة المحددة مسبقا 4-تحقيق و قياس وزن بخار الماء الممتص عند التوازن. يمكن أن يحدث قياس ثقلي لامتصاص الرطوبة بشكل مستمر أو متقطع. يتطلب عادة القياس المستمر وضع العينة على توازن في الحرارة و بيئة الرطوبة النسبية المراقبة. و قد استخدم الميزان المكروي في الأنظمة المغلقة لهذا الغرض بنجاح, ويمكن أن تتحكم الأنظمة التجارية المتوفرة حاليا على وجه التحديد وبدقة بالرطوبة النسبية و بنفس الوقت تراقب وزن العينة. تتطلب الطريقة الحجمية:
1-وزن العينة الجافة 2-درجة حرارة ثابتة للعينة 3-قياس ضغط بخار الماء في حجم الجرعات وبعد ذلك في الفراغ الموجود فوق العينة المتوازنة 4-قياس الحجم الراكد للحجيرات المفردة بما فيها حجيرة العينة. جوهريا فإن الطريقة الحجمية توازن حجما صغيرا معلوما من الفراغ عند قيمة ضغط بخار ماء مقاسة يتبعها تعريض العينة قبل توازنها لهذا الماء مع قياس متتالي لضغط بخار الماء بعد التوازن . نحصل على كتلة الممتص∆n مقدرة بالمولات عند الضغط النهائي للنظام Pf من الفرق ∆p بين Pfcalc ضغط بخار الماء المحسوب عند التوازن وPfmeas ضغط بخار الماء النهائي المقاس
حيث أن V هو الحجم النهائي و R ثابت الغازات وT درجة الحرارة المطلقة .
امتصاص الأجسام الصلبة البلورية للماء : WATER SORPTION BY CRYSTALLINE SOLIDS
النموذج العام : General Model
يمتز الماء على سطح الأجسام الصلبة المتشكلة غير المتميهة عند رطوبة نسبية منخفضة.وبزيادة الرطوبة النسبية يتوقع ميل لحصول امتزاز متعدد الطبقات. سوف يبدأ الجسم الصلب بالانحلال في الطبقة الرقيقة الممتصة للماء عند رطوبة نسبية ( خاصة للمادة المعطاة ) سوف نحصل على الأغلب على محلول مشبع للمادة المنحلة, وهذا سوف يؤدي إلى تناقص ضغط البخار فوق الطبقة الرقيقة الممتصة للماء بشكل نسبي مع الماء النقي و أن يكون ثابتا ومساويا للضغط فوق المحلول المشبع للمادة. يمكن أن يعبر عن ضغط البخار كرطوبة نسبية حرجة RH0 إذا كانت الرطوبة النسبية في الجو أكبر من الرطوبة النسبية فوق المحلول المشبع (RH0 )فإن الماء سوف يتكثف بشكل تلقائي فوق الطبقة الرقيقة المائية.هذا سوف يمدد الطبقة الرقيقة مما يسمح للمادة الصلبة أن تنحل مما يؤدي بدوره إلى الحفاظ على تدرج الضغط. سوف تستمر عملية امتصاص الماء إلى أن تنحل كل المادة الصلبة و إلى أن يحدث المزيد من تمدد المحلول. فقط عندما تزداد الرطوبة النسبية فوق المحلول لتساوي الرطوبة النسبية للجو فإن عملية الامتصاص سوف تنتهي. تسمى هذه الظاهرة بالميوعية. على الرغم من أن المادة المميهة تخضع لتحول الحالة الصلبة عن طريق الانتقال من الحالة الغير مميهة إلى الحالة المميهة كما هو الحال في الانتقال من أنواع حالة مميهة إلى أخرى. يلاحظ أيضا سلوك مشابه لذلك الموصوف سابقا للمواد المميهة عند رطوبة نسبية حرجة للمواد المميهة وفوقها. تتواجد في الأنظمة الصيدلانية أنواع منحلة في الماء بكثرة في الأشكال الصيدلانية . لذلك من الضروري فهم الشروط المسؤولة عن الميوعية و فهم الحالات الجزيئية التي تحدث عند رطوبة نسبية تحت نقطة التميع.
امتصاص الماء فوق الاجسام غير المميهة تحت الرطوبة النسبية الحرجة: Water Sorption onto Non-Hydrates below RH0
يعتمد امتصاص الماء فوق الاجسام غير المميهة البلورية تحت الرطوبة النسبية الحرجة على قطبية السطح و سوف يكون متناسبا مع مساحة السطح. كمثال على ذلك يظهر الماء ميلا صغيرا للامتصاص على الاجسام الصلبة غير القطبية كالكربون والتيفلون ( متعدد رباعي فلور الإيتيلين ) ولكنه يمتص بشدة أكبر على المواد الأكثر قطبية كالهاليدات القلوية و الأملاح العضوية كساليسيلات الصوديوم. ولأن الماء يمتص فقط على السطح الخارجي لهذه المواد فإنه تمتص كميات صغيرة نسبيا من الماء ( عادة أقل من 1 ملغ في كل غرام ) مقارنة مع المواد المميهة والغير بلورية التي تمتص الماء إلى بينتها الداخلية.
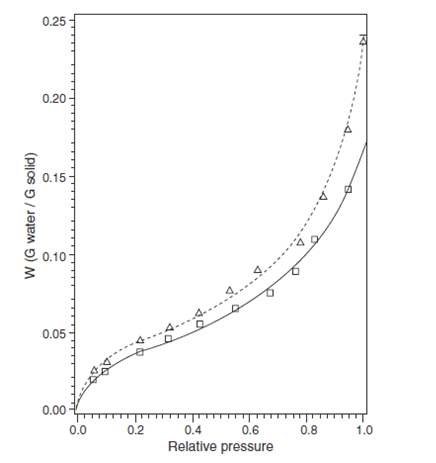
لسوء الحظ اقتصدت المطبوعات على إيراد أمثلة تظهر صورة لامتصاص الماء على المواد البلورية الغير متميهة تحت الرطوبة النسبية الحرجة. وهذا على الأغلب عائد للصعوبة في القياس الدقيق لكمية الماء الصغيرة الممتصة. ويستثنى من ذلك الهاليدات القلوية نتيجة تخصص جزيئاتها مورفولوجيا . يظهر الشكل (2) خط تساوي الحرارة لامتصاص الماء على كلور الصوديوم المعاد بلورته. لاحظ أن هناك كمية من الماء تمتص كتابع للرطوبة النسبية مساوية لمساحة سطح نوعية للعينة. ولأن الماء يمتص فقط على السطح الخارجي للمادة فإن ذلك يسمح بمقارنة بيانات امتصاص الماء من خلال عدة مواد مختلفة , بينما ربط هذه البيانات على أسس بكل غرام ستكون بلا معنى أو ذو معنى قليل.
Fig(2)
امتصاص بخار الماء لكلور الصوديوم الأساسي و كلور الصوديوم المعاد بلورته.
Water vapor sorption for recrystallized ( ) and
ground ( ) sodium chloride at 20_C. (From Ref.[48]).
. يمتص 5 × 10_4 g water/m2 فقط من عينة كلوريد الصوديوم وذلك من أجل عينة كلوريد الصوديوم الموجودة في الشكل 2 (مساحتها السطحية النوعية= 0.0875 m2/g من اجل دراسات الامتزاز على الكريبتون ) وحتى أنه يصل إلى70% من الرطوبة النسبية. وأيضا نلاحظ الطبيعة الخطية الظاهرة لخط تساوي الامتزاز. من أجل بيانات تحليل BET للامتزازعند درجة رطوبة نسبية أخفض فإننا نحصل على قيمة Wm مساوية
ل 7.6 × 10_5 g/m2
هذه القيمة هي فقط 0.32 من القيمة المتوقعة من أجل تغطية طبقة واحدة بافتراض أن مساحة جزيء الماء تساوي 12.5Å2 .وهذا يشير إلى انه لا فائدة من الإشارة إلى عدد الطبقات من الماء الممتز كمتعدد للقيمة Wm إلا كنقطة مرجعية. وبشكل مثير للاهتمام فإن الارتفاع في الخطوة الثانية في الشكل2 يحصل عندما يكون محتوى الرطوبة تقريبا مساويل لثلاثة أضعاف عنه من المناظر لقيمة Wm مشيرا إلى انه من أجل عينة كلوريد الصوديوم فإن الطبقة الاحادية تكون فعلا مكتملة عند الخطوة الثانية من خط تساوي الحرارة. تشيرنتائج حرارة الامتصاص !! لعينة كلوريد الصوديوم من Barraclough and Hall إلى أن حرارة الامتصاص من اجل الماء عند قيم تصل إلى القيمة Wm تكون ثابتة بينما تنقص حرارة الامتصاص وتصبح ثابتة عند ضعف قيمة Wm تقريبا. وباعتبار الخطأ الموجود عند الحصول على قيم . Wm و حرارة الامتصاص!! فإن هذا يشير إلى الماء يمتص بواسطة طاقة رابطة متجانسة عند القيم التي تصل إلى Wm ثم يتفاعل بحد أقل من ذلك حتى يتم تشكيل الطبقة الأحادية. كما يظهر في الشكل 2 وأيضا في عمل Barraclough and Hall فإن امتصاص الرطوبة على كلوريد الصوديوم كتابع للرطوبة النسبية هو تابع عكوس طالما أننا لم نحصل على القيمة RH0 هذا دليل على أن انحلال المادة البلورية في الماء لا يتم عند درجة رطوبة نسبية أقل من RH0 وهذا يتماشى مع العقلانية التيرموديناميكية بأن الانحلال تحت الدرجة RH0 سوف يتطلب محلولا فوق مشبعا ( أن عددا متزايدا من الأنواع في المحلول سوف يكون ضروريا من أجل حث الانحلال عند درجة رطوبة نسبية تحت تلك الدرجة التابعة للمحلول الفوق مشبع RH0 ) .في هذا الخصوص يجب علينا ان نضع في الحسبان خواص الحالة الصلبة للمادة البلورية النقية تحت درجة. RH0 وكما يوصف بدقة بأنه ربما سيتم أخذ اعتبارات أخرى من اجل مادة موجودة في أشكال بوليميرية متعددة أو أنها تمتلك مواد لابلورية.
امتصاص الماء على الأجسام المميهة تحت درجة الرطوبة النسبية: Water Sorption onto Hydrates below RH0
تستخدم العديد من الأدوية والسواغات ( السيفاليكسين أحادي التميه و كبريتات الكيندين ثنائية التميه و الأمبيسيلين ثلاثية التميه و كبريتات الكودئيين ثلاثية التميه و كبريتات المورفين ثنائية التميه و فوسفات ثنائي ا لكالسيوم ثلاثية التميه والرافينوز خماسي التميه و اللاكتوز أحادي التميه) الماء كجزء تام من بنيتها البلورية. تميل الأجسام الصلبة التي تشكل بلورات مميهة معينة إلى امتصاص كميات صغيرة نسبيا من الماء على سطحها الخارجي تحت درجة رطوبة نسبية مميزة وذلك عند تجفيفها بداية إلى حالة غير مميهة. تسلك هذه المواد سلوكا مشابها للمواد الغير متميهة تحت هذه الدرجة من الرطوبة النسبية. عند الوصول إلى هذه الدرجة المميزة فإن أي زيادة من الماء إلى النظام لن تؤدي إلى إلى زيادة أخرى في الرطوبة النسبية. في الواقع فإن هذا الماء سيمتص وبالتالي ستتحول البلورة الغيرمتميهة إلى متميهة. تعتمد قوة التفاعل بين الماء والجسم الصلب على مستوى الرابطة الهيدروجينية الممكنة ضمن الشبكة. في بعض المواد المميهة ( الكافئين و التيوفيلين ) حيث تكون الرابطة الهيدروجينية فيها ضعيفة بشكل نسبي تستطيع جزيئات الماء أن تساعد في الحفاظ على ثبات التميه بشكل أساسي تبعا لقاعدة ملء الفراغ. بماأن جزيئات الماء تشغل مواقع نظامية ضمن شبكة المادة المميهة مع أمثال تفاعل معينة( مثال : 1:1 أحادي التميه و 2:1 ثنائي التميه و 5:1 خماسي التميه ) للمادة الصلبة فلذلك تمتص كميات كبيرة من الماء. يوضح الشكل 3 خط تساوي الحرارة لامتصاص الرطوبة لمادة بروميد الايبراتروبيوم. يجري على هذه المادة تميه ظاهري للبلورات بين 63% و 75% من الرطوبة النسبية . إن 4.6% من الماء تقريبا يمتص فوق نسبة 75% من الرطوبة النسبية ( نظريا 4.4% لأحادي التميه ) بشكل مثير للاهتمام فإن بروميد الايبراتروبيوم يصل إلى التوازن بعد فترات زمنية طويلة ( مثال من شهرين إلى خمسة أشهر على التوالي كما هو موضح في الشكل 3 ) يبدو أن تميه البلورات يظهر عند 53% و 63% من الرطوبة النسبية.
خط تساوي الحرارة لامتصاص والتفاظ الماء لبروميد الايبراتروبيوم عند درجة الحرارة 20 سيليسوس حيث : ( ) نتائج الامتصاص بعد شهرين , ( ) نتائج الامتصاص بعد خمسة أشهر ,( ) نتائج الالتفاظ بعد شهرين إلى خمسة أشهر
( ملاحظة: نتائج الامتصاص بعد شهرين عدا عند 53% و 63% من الرطوبة النسبية تؤكد صحتها بعد خمسة أشهر. )
يظهر هذا المثال بشكل واضح أن فترة عدة أشهر مطلوبة من أجل تحقيق امتصاص توازني عند درجة رطوبة نسبية منتقاة. كميزة للعديد من المواد المميهة, يظهر بروميد الايبراتروبيوم تلاكؤ ذو قيمة بين خط تساوي الحرارة للامتصاص وللالتفاظ. يعود هذا إلى درجة الارتباط والتعبئة الفيزيائية للماء في الشبكة المميهة.
يجب الأخذ بعين الاعتبار التميه الغير محدد أو التميه للشبكة البلورية من دون تحول الطور من المرتبة الأولى. قدم Cox, Woodard, and McCrone تقريرا عن امتصاص الرطوبة لكرومولين الصوديوم و التأثيرات المرتبطة على الخواص الفيزيائية لهذه المادة. على الرغم من أنه تمتص تسعة جزيئات من الماء في كل جزيئ كرومولين الصوديوم ضمن الشبكة البلورية عند 90% درجة رطوبة نسبية فإنه لاتظهر مخطط الامتصاص أي قمة حادة مرتبطة بالتميه الثابت . في الواقع يظهر مخطط الامتصاص زيادة تدريجية في محتوى الرطوبة عند تزايد الرطوبة النسبية التي تظهر كتغير واضح في نموذج الانحراف للأشعة السينية و كتغير في الكثافة وكتغير في خواص فيزيائية أخرى. من أجل هذا المثال يرتبط امتصاص الرطوبة على كرومولين الصوديوم مع انتباج الشبكة البلورية من وجهة نظر علم البلورات والتي ظهر أنها عكوسة بنزع الماء.
من خلال فهم عميق لمخطط التميه لمادة صلبة فإن تشكيل بلورةمميهة مهم لعدة اسباب أولها لأن المادة الغير مميهة والمواد المميهة هي أنواع مميزة ترموديناميكيا وسيكون لها خواص فيزيائية وكيميائية مختلفة ( مثال : الانحلالية) والتي قد تؤثر في الانحلال والتوافر الحيوي وثانيا فإن أنواع مواد مميهة مرغوب بها يمكن تشكيلها واستخدامها و حفظها ببساطة من خلال التحكم بالشروط البيئية المحققة. وثالثا لأن كميات معينة من الماء يمكن امتصاصها تصبح مميهة ويمكن تحرير الماء منها لتصبح مواد غير مميهة لذا الخواص الفيزيائية والكيميائية للنظام الحالي ( المتضمن في جواره أجسام صلبة أخرى) يمكن ان تؤثر بشكل واضح.
الرطوبة النسبية الحرجة The Critical Relative Humidity, RH0
إن معرفة قيمة الرطوبة النسبية الحرجة لكل مكون في الصيغة و للنظام بأكمله هو مهم جدا للتنبؤ بالرطوبة النسبية حيث تتوقع التغيرات الفيزيائية العيانية للنظام و التي تعود إلى انحلال المكونات المنحلة بالماء. تتأثر قيمة الرطوبة النسبية الحرجة كخاصية ضمامية بشكل كبير بعدد الأنواع الموجودة في المحلول. وكقاعدة عامة ، يمكن إجراء تعليقين عامين. الأول أن المركبات التي اتبدي انحلالية قليلة بالماء تملك بشكل نموذجي قيمة للرطوبة النسبية إلى حد بعيد أعلى من 95% من الرطوبة النسبية. و الثاني أنه كلما تزداد الانحلالية تنقص الرطوبة النسبية الحرجة RH0. بما أن السوائل غير المثالية تظهر على شكل محاليل تصبح مركزة أكثر وأكثر فإنه ليس من المحتمل عادة أن يستخدم نماذج محاليل تمييع ( كمثال قانون (Raoult’s للتنبؤ بدرجة الرطوبة النسبية المتوقعة للمنحل الذي يملك انحلالية معينة في الماء ,لذا يجب قياس الرطوبة النسبية الحرجة RH0 لكل جسم صلب بمفرده. يظهر في الجدول (1) أمثلة لقيم الرطوبة النسبية الحرجة لمكونات النظام مفردة.
من جهة أخرى, يمكن حساب قيم RH0 للمزيج من قيم الـ RH0 للمكونات المفردة باستخدام المعادلة المكتشفة من قبل Ross
حيث ( RH0)mix هي الرطوبة النسبية فوق المحلول المشبع من المزيج و (RH0)i تمثل الرطوبة النسبية للمحاليل الملحية المشبعة المفردة. تشتق معادلة روس بفرض أن المحلول ممدد و أن التفاعل بين مكونات المحلول مهمل. تقارن النتائج الواردة في الجدول (2) قيم RH0 المكتسبة من حساب قيم الـ RH0 للمزيج من معادلة روس و قيم الـ RH0 المكتسبة عن طريق التجربة. توافق النتائج هو شيء جيد جدا و خاصة باعتبار المستويات العالية لانحلال المواد المنحلة التي تم الوصول إليها تقدر بأنها عالية ك 50 مولالية بالنسبة ل : لنظام بروميد الكولين إلى بروميد رباعي بوتيل الأمونيوم((the choline bromide/tetrabutylammonium bromide system
حرائك الميوعية فوق الرطوبة النسبية الحرجة. The Kinetics of Deliquescence above RH0
اقترح العمل البدئي الذي قام به Edgar و Swan وAdams و Merz و Prideaux و Morkowitz و Boryta و Carstensen أن معدل امتصاص الرطوبة للأجسام المنحلة بالماء فوق الـRH0 يجب أن يعتمد على الفرق بين الضَّغْطُ الجُزْئِيّ للماء في الوسط المحيط و بين الضغط الجزئي للماء فوق المحلول المشبع من المادة المنحلة بالماء و يعتمد أيضا على درجة الحرارة و على مساحة السطح المعرضة من المادة الصلبة وعلى سرعة الحركة للهواء الندي و على ثابتة التفاعل المحددة التي تكون مميزة لكل جسم صلب على حدا.
طورالعلماء Van Campen و Amidon و Zografi نماذج تصف معدل امتصاص الرطوبة فوق الـ RH0الذي يعتمد نقل كتلة الماء إلى المادة الصلبة و انتقال للحرارة بعيدة عن السطح. لأجل الحالات الخاصة للبيئة المكونة من ماء نقي (كشروط الخلاء البدئية), بُسط نموذج الـ Van Campen و Amidon و Zografi كثيرا وذلك بسبب عدم الحاجة لاعتبار انتشار البخار. يفترض هنا للمعدل الذي عنده تنتقل الحرارة بعيدة عن السطح أن يكون عامل مهم لتحديد معدل الامتصاص W. لهذه الحالة الخاصة , يشتق المصطلح ليعبر عن معدل امتصاص الرطوبة كتابع فقط للرطوبة النسبية للمحيط RH1 و RH0.
ظهر هذا النموذج ليكون قابل للتطبيق من أجل وصف حرائك امتصاص الرطوبة (في الخلاء) فوق الـ RH0 من أجل أنظمة المكون المفرد من الألدهيدات القلوية و السكاكر و أملاح الكولين.
امتد هذا النموذج مؤخرا لأخذ بعين الاعتبار حرائك امتصاص الرطوبة فوق الـ RH0 من أجل أنظمة المكونات المتعددة لهذه المواد.
امتصاص الماء بالأجسام الصلبة الغير بلورية: WATER SORPTION BY AMORPHOUS SOLIDS
تحليل خط تساوي الحرارة عند درجات حرارة المحيط. Isotherm Analyses at Ambient Temperatures
إن كمية الرطوبة الممتصة من قبل الأجسام الصلبة الغير بلورية أكثر بشكل قياسي من كمية الرطوبة الممتصة من قبل المواد البلورية الغبر مميه تحت درجة رطوبتها النسبية الحرجة. تضم المواد النموذجية فيما بتعلق بالاهتمام الصيدلاني السيلليلوز و النشاء و متعدد (فاينيل البيروليدون) و الهلام و بعض البروتينات المجمدة. على الرغم من أن بعض هذه المواد تظهر خاصية بلورية بشكل جزئي فإنها تحتوي بشكل عام على أجزاء معتبرة من المادة الغير بلورية ولذا ضمت إلى هذا الصنف من المواد. يظهر في الشكل 4 خط تساوي الحرارة النموذجي للسيللوز البلوري المكروي. لاحظ أن الكميات المعتبرة من الماء الممتصة خلال كامل مجال الرطوبة النسبية و أن كلا خطوط تساوي الحرارة للامتصاص و الالتفاظ تُميز بشكل حرف S التقليدي غالبا تلاحظ عند الادمصاص الفيزيائي للغازات. و الظاهر أيضا هو التلاكؤ بين أقسام الامتصاص و الالتفاظ لخط تساوي الحرارة (ككمية الماء المرتبطة بالمادة الصلبة هي أكثر لخط تساوي الحرارة للالتفاظ منه للامتصاص و ذلك لأجل رطوبة نسبية محددة) . هذا نموذجي لهذه الأنواع من المواد و تنسب بشكل عام إما إلى تأثيرات الحرائك أو للتغيير في هيئة سلاسل البوليمر الناتجة عن تأثيرات التلدن للماء الممتص.
يظهر الشكل 4 التوافق الممتاز لمعادلةGAB لخط تساوي الحرارة لامتصاص و التفاظ السيللوز البلوري المكروي. في هذا الموضوع, قدمت هذه المعادلة استعمالا تطبيقيا معتبرا لتناسب خط تساوي الحرارة لهذه الأنواع من المواد خلال كامل مجال الرطوبة و خصوصا بالمقارنة مع معادلة BET التي تلائم عادة فقط معطيات الامتصاص التي تصل تقريبا لـ 40% من الرطوبة النسبية. و مع ذلك كما ذكر سابقا فهي لا تلائم بحد ذاتها المصداقية لنموذج GAB لأجل وصف معطيات امتصاص الرطوبة لهذه المواد. في الواقع فإن بيانات غير معتمدة للطرائق الفيزيائية تكون ضرورية
اكتسبت النظرية المادية المعتبرة في آلية الربط الأولي للماء على النشاء و السيللوز من تحليل خط تساوي الحرارة و التي تعطي قيم ل Wm و يتضح ذلك في الجدول 3 الذي يعطي قيم Wm لأنواع النشاء الثلاثة. ويبين الجدول 3 أن قيم Wm ثابتة تماما على الرغم من الاختلافات الشكلية المعتبرة بين مختلف النشويات. و يبدو أن قيمة واحدة من Wm المأخوذة من نوبة معطيات الالتفاظ أعلى بقليل من القيم المأخوذة من بيانات الامتصاص.
خط تساوي الحرارة لامتصاص بخار الماء ( ) و التفاظ بخار الماء ( ) للسيللوز البلوري المكروي عند 20 درجة سيلسيوس
Solid line: GAB fit to sorption Data
Dashed line: GAB fit to desorption data.
هذا من المتوقع أن يكون إذا حدث تزايد في توافر مواقع الامتصاص الأولية عن طريق تعرض سابق لارتفاع رطوبة نسبية مع تزايد متتالي لمستويات امتصاص الماء. كما هو موضح في قاعدة Van den Berg et al. وآخرون ’ تقترب هذه القيم لـ Wm للقيمة 0.11 غرام من الماء من أجل غرام واحد من النشاء المحسوبة بافتراض امتصاص جزيء ماء واحد لكل وحدة غليكوز منزوعة الماء. بما أن هذه الحسابات تفترض توافر جميع وحدات الغليكوز منزوعة الماء للارتباط الأولي وبما أنه ليس من المرجح أن تكون هذه هي الحالة على وجه التحديد ’ فإنه ليس من المستغرب أن هذه القيم المقاسة لـ Wm هي أقل قليلا من 0.11 غرام /غرام.
وقد وسع Zografi et al وآخرون هذا التحليل إلى امتصاص الماء بمواد مختلفة من السيللوز. التصحيح ضروري من أجل السيللوز وذلك لأن بخار الماء يحتل فقط المناطق اللابلورية. يبين الجدول 4 قيم Wm المستمدة من تحليلات خط تساوي الحرارة لمواد سيللوزية متعددة بعد إجراء حساب لدرجة التبلور. كما هو متوقع يظهر السيللوز ذو درجات مختلفة من التبلور قيم مختلفة من Wm بدون تصحيح لمعدل التبلور وهي كلها أقل إلى حد كبير من Wm المحسوبة للنشاء. ومع ذلك عند التصحيح لدرجة التبلور فإن جميع قيم ال Wm تكون على توافق منطقي مع بعضها البعض ومع قيم الـ Wm المستمدة من النشاء. مما يثير الاهتمام بشكل خاص النتائج الموجودة في الجدول 4 لعينات السيللوز البلورية المكروية التي تملك درجات مختلفة من التبلور العائدة إلى الطحن. تشير هذه النتائج إلى تشابه آلية قبط الماء التي تحدث في النشاء وفي المناطق غير البلورية للسيللوز.
وترد تحليلات مشابه لبيانات قبط الرطوبة في (الأدب) لمشتقات النشاء و السيللوز الأخرى المستعملة كسواغات صيدلانية الموجودة في الجدول رقم 5. إذا أخذنا بعين الاعتبار الالتباس المرتبط مع قيم قبط الرطوبة المقدرة من الخط البياني المنشور نجد تناسق تام لجميع قيم الـ Wm مع بعضها البعض ومع الأمثال الاستيكومترية لجزيء ماء واحد لكل وحدة سكرية لا مائية. ومن المثير للاهتمام أن نلاحظ أن العينتين المشتقتين من السيللوز (كَرْبُوكْسِي ميثيل سيللوز الصودي و كربوكسي ميثيل سيللوز الصودي المتصالب) لا يتطلبان أي تصحيح لدرجة التبلور لتتطابق بشكل دقيق مع الأمثال الاستيكيومترية 1:1 وبالتالي يبدو من المرجح تماما أن التغير في البنية الكيميائية و في معالجة هذه المواد يلغي بشكل أساسي تبلور السيللوز.
يشير التحليل السابق فعلا إلى نفاذ الماء في أرجاء المناطق الغير بلورية لهذه المواد و خضوعه لتفاعل محدد مع مواقع الامتصاص المتوافرة ,على الأرجح مجموعات الهيدروكسيل المتاحة , على وحدات الغليكوز الغير مائية. يدعم هذا النموذج اختلاف الحرارة في الامتصاص الناتجة من مواد نشوية و سيللوزية مختلفة.
الجدول 4 :
قيم Wm للسيلوز متنوع مأخوذة من تحليل BET لخط تساوي الحرارة لامتصاص الرطوبة المصصحة صححت من أجل درجة تبلور.
الجدول 5: قيم Wm لصواغات صيدلانية متنوعة مأخوذة من تحليل BET لخط تساوي الحرارة لامتصاص الرطوبة
تشير البيانات المجموعة إلى أن هناك تفاعل محدد بين المادة الصلبة و الماء حسب محتوى الرطوبة وهو يعادل على الأقل ثلاث أضعاف الـ Wm. يظهر الماء الموجود في النظام خلال هذا النطاق ليبقى في حالة أكثر تنظيما (على سبيل المثال أقل حركة) من كتلة الماء .من المثير للاهتمام , تظهر حرارة الامتصاص فواصل غير مترابطة مترافقة مع الأمثال الاستيكومترية لجزيء أو جزيئين ماء لكل وحدة غليكوز غير مائية. تشير بعض اختلافات حرار الامتصاص الناتجة التي تبقى تقريبا ثابتة خلال مجال الـ Wm إلى تجانس الارتباط خلال هذا المجال. ومع ذلك هذا لايحدث دائما. و تم إثبات ذلك من خلال بيانات حرارة التبخرعلى عينات السيللوز المصرح عنها من قبل Etzler وConners
تزداد حرارة الانتزاز للماء من القالب بشكل مستمر كما قيس باستخدام DSC/TGA معا عندما يقل محتوى الرطوبة عن حوالي ( نصف غرام ماء لكل غرام سيللوز) تقريبا (حوالي ثلاثة أضعاف من Wm ) , تشير هذه النتائج إلى أن وجود الماء في عدة حالات مختفلة طاقيا.
يوجد دليل داعم آخر لتفاعل محدد للمادة الصلبة مع الماء من خلال دراسات حرارية تظهر كمية الماء غير القابل للتجمد و الطنين المغناطيسي الذري ودراسات الانتشار. هذا الدليل غير واضح في خصوص إذا كان هناك ارتباط محدد للماء مع مواقع الامتصاص فإن الماء يتصرف بدرجة حركة مقبولة وبالتالي يشكك في استخدام مصطلح ( الماء المرتبط ) .
تحليل خط تساوي الحرارة كتابع للحرارة Isotherm Analyses as a Function of Temperature
وبصفة عامة ، ينقص امتصاص الماء على الأجسام الصلبة الغير متبلورة كتابع للرطوبة النسبية كلما زادت الحرارة مما يعكس طريقة إجمالية ناشرة للحرارة ويتوقع بشكل طبيعي مع عمليات امتصاص البخار. ويلاحظ هذا السلوك مع السيللوز و النشاء و متعدد فينيل البيروليدون و متعدد ميتيل الميثاكريلات. ويفترض في مثل هذه الحالات أن العامل المسيطر هو غالبا الحرارة السلبية للامتصاص الناشئة من التغير في مدى ربط الماء. ومع ذلك فإن العملية هي أعقد من ذلك وذلك بسبب تغير في الشكل و بالتالي تغير في العشوائية. ويمكن ملاحظة تعقيد آثار الحرارة على امتصاص بخار الماء و الروابط الممكنة للتأثيرات الملدنة للماء في عمل Oksanen و Zografi اللذين سجلا تناقص قيم الـ Wm لمتعدد فينيل البيريلدون خلال مجال الحرارة 40 -60 درجة سيليسوس ثلاثة مرات مشيرا إلى أن قيمة Wm لا تعكس الرقم المطلق لمواقع الارتباط المتاحة على البوليمير ضمن مفهوم " الماء المرتبط" بالإضافة إلى أنه يظهر هناك صلة بين Wm و W (درجة الانتقال الزجاجيTg=T هي درجة كمية الماء الممتص الذي سيخفض درجة الانتقال الزجاجي إلى درجة حرارة العينة بمعدل W(Tg = T)/Wm الذي يبقى ثابتا تقريبا عند 3.0 خلال مجال الحرارة الكامل.
كملخص لما سبق أن الماء يمتص على البوليمير اللابلوري إلى حد معين . يحدث التفاعل لجزيئات الماء مع مواقع الامتصاص المتاحة عن طريق الروابط الهيدروجينية مما يسبب انخفاضا في حركية الماء الممتص وتغيرا ملحوظا في الحالة الترموديناميكية للماء نسبة إلى كتلة الماء . ومع هذا يظهر أن نفوذية الماء إلى جميع مواقع الامتصاص المتاحة تكون معتمدة على التاريخ السابق و الخواص الفيزيائية والكيميائية للمواد الصلبة.وفي هذا الخصوص فإن تفاعل المادة الصلبة مع الماء في انظمة البوليميرات اللابلورية هو علاقة ديناميكية معتمدة بشكل قوي على فعالية الماء ودرجة الحرارة.
==معنى مساحات السطح النوعية من خلال دراسات امتصاص الماء: Areas Calculated from Water Absorption Studies Teh Meaning of Specific Surface==
يوصلنا ببساطة حساب مساحات السطح النوعية من خلال قيم Wm الموجودة في الجداول3-5 إلى مساحات سطح نوعية ظاهرية تعادل تقريبا 300–500m2/gولكن مساحات السطح النوعية المأخوذة من تحليلات مشابهة لدراسات امتزاز أجريت على غازات لا قطبية ( نتروجين أو كريبتون) هي بشكل مطابق مستقلة عن معالجة العينات خلال المجال 1m2/g.
وبشكل مثير للاهتمام أظهرت دراسات طحن الكرة التي أجراها العالم Nakai على السيللوز الميكرو بللوري ( الجدول 4) أن قيم... المأخوذة من دراسات امتصاص الماء تزداد إلى حد كبير أكثر من الازدياد الحاصل في مساحة السطح بسبب تفتيت العينة. في الحقيقة وكما تم مناقشته سابقا فإنه ظهر تناسب بين امتصاص الماء مع مقدار الصفة اللابلورية مشيرا إلى أن الماء يمتص من خلال المناطق اللابلورية للمادة. في هذا الخصوص تؤخذ مساحات السطح النوعية للمواد الصنعية إذا حسبت من بيانات امتصاص الماء لهذه الأانواع من المواد.
دور الماء كعامل ملدن: The Role of Water as a Plasticizer
يظهر امتصاص البنية الداخلية للمادة الصلبة لكميات معتبرة من الماء تأثيرا على خواص المواد الصلبة. يتوضح ذلك على سبيل المثال من خلال التلاكؤ الملاحظ بين خط تساوي الحرارة للامتصاص والالتفاظ الموجود في الشكل4. تصبح هذه الظاهرة مبالغا بها إلى حد كبير في المواد المكونة من نسب عالية من المواد اللابلورية .شرح. Levine و Slad أن الماء ذو درجة انتقال زجاجي منخفضة جدا يمكن أن يتصرف كعامل ملدن لأنه يخفض درجة الانتقال الزجاجي للبوليميرات اللابلورية. كما يلاحظ سلوك مشابه لذلك في المواد الصلبة اللابلورية ذات الأوزان الجزيئية المنخفضة. كما تم ملاحظته فإن الخواص اللزجة للمود الصلبة تتغير بشكل معتبر فوق درجة الانتقال الزجاجي ( الحالة المطاطية) نسبة إلى تحت درجة الانتقال الزجاجي ( الحالة الزجاجية) فإنه غالبا ما يطرأ على المادة الصلبة تغييرات في الخواص الفيزيائية عند محتويات رطوبة معينة ودرجات حرارة محددة كنتيجة لهذه الظاهرة. وقد أظهر .....على البولي فينيل بيرليدون أن محتوى الرطوبة عندما يبدأ خط تساوي الحرارة بالتزايد بشكل ملحوظ يرتبط بشكل جيد مع محتوى الرطوبة الذي سوف يقلل الـ Tg إلى درجة حرارة خط تساوي الحرارة. ويتضح ذلك في الشكل 5 الذي يظهر خط تساوي الحرارة لامتصاص الماء للبولي فينيل البيرليدون خلال مجال الحرارة من( -40 إلى 60.درجة مئوية). بشكل واضح فإن نقطة الالتواء التي يبدأ عندها خط تساوي الحرارة بالانقلاب نحو الأعلى بشكل ملحوظ إلى محتوى أعلى من الرطوبة عندما تتناقص الحرارة. ولتوضيح ذلك, لاحظ أن محتوى الرطوبة الضروري (0.674غرام لكل غرام) لإنقاص ال Tg إلى -40 درجة سيلسيوس لم يظهر في الشكل 5 و يبدو خط تساوي الحرارة أنه خطي فعلا على مجال الرطوية النسبية المعروض. ولمزيد من الإيضاح, فإن محتوى الرطوبة [W(Tg = T)] الموافق لـ Tg عند 60,30, 20- , -40درجة سيليسوس يظهر بحوالي 0.205,0.313, 0.553و 0.674 غ لكل غرام بالتوالي. و ذكر Oksanen و Zografi أن السيللوز و بروتين الإلستين يبدي علاقة مماثلة عندما يتوافق التحول من زجاج إلى مطاط مع الالتواء التصاعدي في خط تساوي الحرارة الخصوصي.
وأثبتت الدراسات المتتالية عن طريق Hancockو Zografi أن درجة حرارة الانتقال الزجاجي لـ PVPو سيللوز الميتيل و متعدد ميتيل الميتاأكريل تنخفض بشكل خطي بجزء الوزن للماء الممتص وفقا لمعادلة Gordon–Taylor/Kelly–Bueche المبسطة.
حيث أن W1 و W2 هو جزء الوزن للمركبات مع قيم Tg : Tg1 و Tg2 . تشير النتائج بشكل واضح أن الخصائص اللزجة للمواد الغير بلورية يطرأ عليها تغيرات هامة كالتحولات الصلبة من الحالة الزجاجية للحالة المطاطية. و علاوة على ذلك, تحدث هذه التغيرات نتيجة إما لارتفاع درجة الحرارة عند محتوى رطوبة ثابت أو لارتفاع في محتوى الرطوبة عند درجة حرارة ثابتة أو نتيجة اتحاد هذين الأثرين. بالنسبة للمواد الجافة الغير بلورية ,يبدأ التنقل الجزيئي للمواد الصلية بالتحسن بشكل ملحوظ بالنسبة للحالة الزجاجية المنخفضة لـ 50 تحت الـ Tg.تشير التزايدات المتماثلة في التنقل الجزيئي نتيجة التأثيرات الملدنة للماء الممتص إلى الحاجة للحفاظ على النظام اللابلوري على الأقل 50 درجة سيلسيوس تحت درجة حرارة نظام التغير الزجاجي وذلك لتجنب التغيرات في الخواص الفيزيائية و الكيميائية و الميكانيكية خلال عمر المنتج على الرف. بعض الخصائص التي من الممكن أن تتأثر تشمل : رصّ المضغوطات و هشاشة الكبسول الجيلاتيني و انهيار المساحيق الغير بلورية المجففة بالتجميد و ثباتية البروتين و ثباتية الوزن الجزيئي المنخفض و حساسية الأدوية الممتزجة مع المواد البوليمرية اللابلورية للرطوية.
==امتصاص المواد الصلبة المعرضة للتصنيع للماء WATER SORPTION BY PHARMACEUTICAL SOLIDS SUBJECTED TO PROCESSING==
يسمح فهم آليات امتصاص الرطوبة بواسطة المواد الصلبة المتواجدة سواء في الشكل البلوري أو الغير بلوري بتقدير مفهومي للنقاط الحرجة عندما تحدث تغيرات أساسية في الخواص الفيزيائية والكيميائية متل (RH0) الرطوبة النسبية للمواد البلورية المميه) ومع ذلك فغالبا ما تحث عمليات التصنيع للمواد الصيدلانية الصلبة (كالطحن و التجفيف بالإرذاذ و الرصّ و التجفيف بالتجميد) التغيرات الجزئية لمعظم المواد إلى أشكال طاقية أعلى. وقد ارتبطت هذه الاضطرابات الموضعية مع التفاعلية الكيميائية المتزايدة و الانحلالية المتزايدة بشكل نسبي مع الحالة البلورية المفضلة ترموديناميكيا. ويشار إلى هذه المناطق بالنقط --الساخنة- لأغلب المواد الصلبة و عندما تتواجد تترك المادة الصلبة في الحالة النشطة.
يعقد عدم التجانس هذا الموجود في المواد الصلبة المصنعة دراسة ظاهرة امتصاص الرطوية لهذه المواد وذلك لأنه يجب الأخذ بالاعتبار أكثر من ميكانيكية لامتصاص الطاقة. وهذا بالأخص أمر صعب وغالبا ما يكون محبطا في الحالات التي تتواجد فيها كميات صغيرة فقط من المواد اللابلورية ويتطلب إيجاد التقنيات التجريبية لإتمام هذه التحليلات عملا مكثفا. ومع ذلك, يمكن لنسب صغيرة نسبيا من المواد اللابلورية أن تمتص كميات معتبرة من الماء داخل بنيتها وهذه المناطق تخضع لتغيرات معتبرة و تأثير متتاليا على الخواص الإجمالية للمواد بمعظمها. وهذا أمر مهم للمواد منخفضة الوزن الجزيئي التي تملك القدرة على على إعادة البلورة بسهولة نتيجة الحركة الإجمالية الكبيرة وذلك بالنسبة للمواد البوليميرية مرتفعة الوزن الجزيئي. ويظهر ذلك لمساحيق كلور الصوديوم و مساحيق ساليسات الصوديوم لمدة 15 دقيقة في المدقة والهاون. في حين لاتظهر المواد المعاد بلورتها أي تغير في مساحة السطح النوعية مع زيادة الرطوبة النسبية, تظهر مساحيق العينة انخفاض معتبر في مساحة السطح النوعية مع زيادة الرطوية النسبية. يوضح الشكل 2 صور لامتصاص الرطوبة المختلفة لعينات مساحيق كلور الصوديوم و عينات كلور الصوديوم المعاد بلورتها المطبع لمساحة السطح النوعية. في حين تمتص مساحيق المواد ماء أكثر بكثير عند رطوبات نسبية منخفضة مقارنة مع العينات المعاد بلورتها التي تمتص كميات أكير عند رطويات نسبية مرتفعة. ويعود هذا الانخفاض النسبي في سعة الامتصاص لعينة المساحيق إلى انخفاض في مساحة السطح كلما زادت الرطوبة النسبية ويعود ذلك إلى إعادة التبلور المتتالي لأسطح المواد المضطرب. ويظهر Fukuoka و Makita و Yamamura أنه يمكن بالفعل لمجموعة المواد الصيدلانية أن تصنع أشكال لابلورية و علاوة على ذلك تظهر درجة انتقال زجاجي خلال المجال من 243 كيلفن إلى 354 كيلفن. وكمثال على ذلك تظهر كل من المواد: الأسبيرين و البروجيسترون و الفينوباربيتال و سلفاديميتوكسين قيم Tg هي243 و 279 و 321 و 339 كيلفن على التوالي.
بالتماثل مع الأنظمة البوليميرية اللابلورية , تظهر المواد اللابلورية منخفضة الوزن الجزيئي أيضا انخفاض في قيم الـ Tg كلما زادت محتوى الرطوبة مما يؤدي إلى شروط ملائمة لحدوث إعادة التبلور. في الواقع تمتلك المواد الصلبة اللابلورية منخفضة الوزن الجزيئي حركة جيدة جزيئة كافية تحت الـ-----. في بعض الأنظمة ذات حالات صلبة متعددة ممكنة, تؤثر فعالية الماء Tg محتوى الرطوبة على الشكل المتبلور للمادة الصلبة . لسوء الحظ, تؤدي إعادة التبلور للأنظمة الغير بلورية اللامائية منخفضة الوزن الجزيئي لتحرير كميات كافية من الماء إلى فراغ الرأس. يمتلك مقلب الرطوية هذا تأثير إضافي على الخواص الفيزيائية و الكيميائية و الميكانيكية للنظام.
ولتوضيح ذلك أكثر من الناحية الكمية,اعتبر كمثال السكروز الافتراضي المناقش من قبل Ahlneck و Zografi. بافتراض أن كل الماء الممتص يشغل القسم اللابلوري للمادة فإنه سوف يندمج 0.1% من الرطوبة الكلية بشكل تقريبي مع 20% و 10% و 4% و 2% من محتوى الرطوبة من المادة اللابلورية على التوالي لكل من 0.5% و 1% و 2.5% و 5% من المادة الصلبة اللابلورية. تتراوح درجات حرارة الانتقال الزجاجي للأقسام اللابلورية لهذا النظام من 9 إلى 49 درجة سيليسوس على التوالي. وبالتالي يتوقع تغيرات هامة في خواص الحالة الصلبة عند درجة حرارة الغرفة إذا تواجد في البداية كميات صغيرة نسبيا من المادة اللابلورية (أي أقل من 1%). يوضح هذا المثال أنه حتى من أجل المواد ذات محتوى رطوية منخفض يمكن أن يحدث تغيرات مهمة في المناطق اللابلورية الموضعية للمادة الصلبة والتي يمكن أن تؤثر على خواص المواد المتأثرة بالحركة الجزيئية.
يمكن إنجاز تثبيط الحوادث الناتجة من زبادة الحركة الجزيئية العائدة إلى زيادة امتصاص الرطوبة و الانخفاض المتتالي في الـTg عن طريق صياغة هذه المواد مع مواد لابلورية مرتفعة الـTg. التأثير الصافي هو زيادة التفاعل الجزيئي و رفع نظام الـ Tg إلى مستوى تعود فيه الحركة الجزيئية مرة أخرى لتنخفض بمافيه الكفاية (لزوجة عالية) بحيث أن التغيرات الغير مرغوبة في الخواص لايمكن أن تحدث.
يمكن لف إعادة التبلور للأنظمة اللابلورية منخفضة الوزن الجزيئي بواسطة أثر التغيرات البنيوية على المواد. على سبيل المثال, ينتج a-lactose اللاكتوز أحادي التميه المجفف بالرذاذ بشكل نموذجي مادة لا بلورية بشكل تام كما حددت بواسطة انعراج الأشعة السينية. و مع ذلك, بخضع اللاكتوز لدوران متعلق ب المُصاوِغُ الكَربُونِيلِيّ في المحلول مما يسبب تغير في البنية الأساسية للجزيء. الأثر على هذا التغير البنيوي على امتصاص و موازنة الماء على اللاكتوز اللابلوري هو أثر ذو معنى. سوف ينتج كما هو متوقع زيادة في محتوى الرطوبة على شكل كبت في درجة حرارة الانتقال الزجاجي إلى نقطة حيث يحدث فيها التبلور الآني. و مع ذلك, المواد الناتجة هي غير منتظمة بحيث يوجد شكلين مختلفين من اللاكتوز أحده هو اللامائي في الحالة اللابلورية. علاوة على ذلك, يمكن أن يخضع الشكل اللامائي b-anhydrat اللابلوري عند ارتفاع الرطوبة إلى تغير بنيوي في الحالة الصلية و ينتج a-monohydrate أحادي التميه. يحتاج تقييم البيانات المحسوبة أن يستكمل في سياق الوصف الدقيق للأشكال الصلبة الممكنة.
==نقل الماء بين المكونات الصلية عبر فراغ الرأس TRANSFER OF WATER BETWEEN SOLID COMPONENTS VIA THE HEADSPACE==
الجمع بين المواد الصلبة التي تم معايرتها مسبقا عند درجات رطوبة نسبية مختلفة ينتج على شكل نظام غير مستقر ترموديناميكيا بسبب وجود ميل لتوزع الرطوبة في النظام بحيث يبلغ رطوبة نسبية مفردة في فراغ الرأس. كما هو موضح في الشكل 6, فإن الرطوية ستلتفظ إلى فراغ الرأس من المكونات المتوازنة من البداية عند درجات رطوبة نسبية عالية و ستمتص إلى المكونات المتوازنة من البداية عند درجات رطوبة نسبية منخفضة. تستمر هذه العملية إلى أن يتم توازن كلا المواد الصلبة عند درجة الرطوبة النسبية النهائية. يمكن للشخص التنبؤ مسبقا بالرطوبة النسبية النهائية عن طريق نموذج انتقال التقاط و التفاظ الرطوبة (SDMT) model إذا كان يملك خط تساوي الحرارة لامتصاص الرطوبة لكل واحد من المكونات الصلبة من محتوى الرطوبة البدائية
التمثيل الترسيمي لانتقال الرطوبة بين المكونات الصلبة A و B على التوالي.
(A) فراغ الراس المعزولة عن بعضها البعض و (B) فراغ الرأس السامح بالتوازن.
RA وRB هم الرطوبات النسبية البدئية فوق A و B على التوالي.
VA وVB هما حجوم فراغات الرأس فوق A و B على التوالي.
Rfو-VT هم الرطوبة النسبية النهائية و حجم فراغ الرأس فوق A وB على التوالي.
محتوى الرطوبة والأوزان الصلبة و حجم فراغ الرأس و درجة الحرارة. ويمكن تقييم محتويات الرطوبة النهائية لكل من المادة الصلبة بسهولة من خط تساوي الحرارة الخاص بالمادة الصلبة.
يملك نموذج SDMT فائدة عملية في المساعدة في التحسين الرشيد لمحتويات الرطوبة البدائية لمكونات النظام الفردية للحصول على الرطوبة النسبية النهائية المطلوبة. تتضمن التطبيقات العملية حتى الآن ضبط تركيبة الـLODS البدائية قبل ملء المحافظ لتجنب هشاشة المحافظ الجيلاتينية باستخدام تركيبة محتوى الرطوبة المناسبة و مقدار التجفيف للحفاظ على الرطوبة النهائية داخل الوعاء تحت القيمة المحددة واختيار تصميم منشقة للبودرة الجافة مناسب و شروط للتعبئة من أجل ثباتية مثلى.
الخاتمة
تتواجد الرطوبة في كافة الأدوية الصيدلانية الصلبة و الأشكال الجرعية و معظم تقنيات المعالجة. فهم تواجد ثمالة الماء و حالته و الأسلوب التي تؤثر فيها على خواص المواد المفردة و خواص الخلائط و في النهاية على أداء المنتج النهائي وكماله كلها ضرورية لتطوير العلماء لفهم أفضل لدور الماء في النظام الخصوصي. وكأهمية بصورة خاصة حرائك قبط وخسران الرطوبة و قيم توازن القبط كتوابع للرطوبة النسبية سواء كانت ثمالة الماء خارجية أو امتصت إلى الجسم الصلب و درجة ارتباط الماء بالجسم الصلب و ميول الماء لإعادة التوزع في النظام المكون من أكثر من مادة صلبة. يمكن توجيه تطبيقات هذه الأفكار الأساسية لتطوير الإنتاج في فهم دور الرطوبة في التأثير على الخواص الفيزيوكيميائية للمواد الصلبة على الرغم من أن تفاعلات الماء مع المادة الصلبة يمكن أن تكون معقدة كثيرا في الأنظمة الصيدلانية.